
| A. | ns电子的能量可能低于(n-1)p电子的能量 | |
| B. | 6C的电子排布式1s22s22px2反了洪特规则 | |
| C. | 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理 | |
| D. | 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理 |
分析 A.电子能量与能层和能级都有关;
B.洪特规则:在能量相等的轨道上,自旋平行的电子数目最多时,原子的能量最低.所以在能量相等的轨道上,电子尽可能自旋平行地多占不同的轨道;
C.能量最低原理:原子核外电子先占有能量较低的轨道,然后依次进入能量较高的轨道;
D.泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态 相反的电子.
解答 解:A.电子能量与能层和能级都有关,ns电子的能量一定高于(n-1)p电子的能量,故A错误;
B.根据洪特规则知,2p轨道上的两个电子应排在不同轨道上,则1s22s22px2反了洪特规则,正确的排布式为:1s22s22px12py1,故B正确;
C.3d能级的能量高于4s能级,电子排布式(21Sc)1s22s22p63s23p63d3中,没有填充4s能级,就填充了3d能级,违背能量最低原理,故C正确;
D.根据泡利不相容原理知,3p轨道最多排6个电子,则1s22s22p63s23p10违反了泡利原理,故D正确;
故选A.
点评 本题考查了原子核外电子排布,题目难度中等,明确保里不相容原理、洪特规则、能量最低原理等知识为解答关键,注意掌握原子核外电子排布规律,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氟气发生取代反应可以制得CH3F | |
| B. | CH3F分子中含有离子键 | |
| C. | CH3F分子中含有共价键和离子键 | |
| D. | CH3F的摩尔质量是34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H=一124.2kJ•mol-1 | B. | △H=+124.2kJ•mol-1 | ||
| C. | △H=+248.4kJ•mol-1 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )
科学家研制的离子液体火箭推进剂AF-M315E,其主要成分是羟基硝酸铵,它比肼燃烧释放能量更高、更安全、环保.下列说法不正确的是( )| A. | 羟基硝酸铵中阳离子的各原子共平面 | |
| B. | 羟基硝酸铵易溶于水 | |
| C. | 羟基硝酸铵中含有离子键和共价键 | |
| D. | 9.6g羟基硝酸铵中含有0.2mol离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
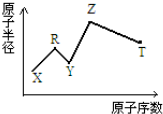 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡.六种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 简单的气态氢化物的沸点和稳定性排序均为:Y>T | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com