
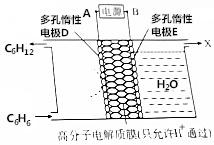
 利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )
利用电化学原理,使苯(C6H6)转化为环己烷(C6H12)可实现电化学储氢和储能;反应装置如图所示,下列判断错误的是( )| A. | A极为电源的正极 | |
| B. | 储氢反应的电极反应式为:C6H6+6H++6e-═C6H12 | |
| C. | 右室得到的气体X为O2 | |
| D. | 该储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑ |
分析 电解池阳极发生氧化反应生成氧气,阴极上苯得电子发生还原反应和氢离子生成环己烷,据此分析.
解答 解:A、阴极上苯得电子发生还原反应和氢离子生成环己烷,A接电源负极,故A错误;
B、阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故B正确;
C、该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,电解池阴极与电源负极相连,得出电解过程中产生的气体X为O2,故C正确;
D、阳极反应式+阴极反应式=总反应式,所以储氢和储能的反应为2C6H6+6H2O$\frac{\underline{\;通电\;}}{\;}$2C6H12+3O2↑,故D正确;
故选A.
点评 本题考查了电解池电极和电极产物的判断,注意根据阳极发生氧化反应,阴极发生还原反应判断,题目难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②④ | C. | ②③④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl- | |
| B. | NaHS溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=10-13mol•L-1的溶液中:NH4+、Mg2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.01mol•L-1的醋酸溶液中,pC(H+)=2 | |
| B. | 常温下,向0.01mol•L-1的氨水中加入等体积等浓度的盐酸,混合液的pC(H+)<7 | |
| C. | 100℃时,0.01mol•L-1的NaOH溶液中,pC(OH-)+pC(H+)=14 | |
| D. | 100℃时,CaCO3的Ksp=2.5×10-9,其饱和溶液中pC(Ca2+)+pC(CO32-)=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molSO2、0.5molO2、1molSO3 | B. | 4molSO2、2molO2 | ||
| C. | 4molSO3 | D. | 1molSO2、1molO2、1molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COONH4 | B. | NH3•H2O | C. | NH4Cl | D. | NH4HSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com