
分析 (1)硫酸氢钠完全电离生成氢离子,导致溶液呈强酸性,抑制水电离;
(2)向水中加NaHCO3固体,是强碱弱酸盐,水解对水的电离起促进作用,溶液呈碱性;
(3)能水解的盐溶液促进了水的电离,碱溶液中的氢离子是水电离的,CH3COONa溶液中的氢氧根离子是水电离的;
(4)根据热化学方程式的书写原则和注意问题写出;注意物质的聚集状态标注,焓变的正负号和单位;
(5)稀释会促进若电解质的电离.
解答 解:(1)硫酸氢钠完全电离生成氢离子,导致溶液呈强酸性,抑制水电离,水的电离平衡逆向移动,故答案为:左;酸;
(2)向水中加NaHCO3固体,是强碱弱酸盐,水解对水的电离起促进作用,所以水的电离平衡向右移动,谁强显谁性,溶液呈碱性,故答案为:右; 碱;
(3)能水解的盐溶液促进了水的电离,碱溶液中的氢离子是水电离的,CH3COONa溶液中的氢氧根离子是水电离的,所以c(OH-)=$\frac{1×1{0}^{-14}}{1{0}^{-9}}$=1×10-5mol/L,水电离出氢离子与氢氧根离子的浓度相等,故答案为:1×10-5mol/L;
(4)16g液态肼和.足量 H2O2混合反应,生成氮气和水蒸气,放出258.0kJ的热量,即0.5mol液态肼和足量双氧水反应生成氮气和水蒸气时放258.0kJ的热量;肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-516KJ/mol,又因为:H2O(l)=H2O(g)△H=+44kJ/mol,所以液态肼与液态双氧水反应生成液态水时的热化学方程式:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O (l)△H=-692.0 kJ/mol,故答案为:N2H4(l)+2 H2O2(l)=N2(g)+4 H2O (l)△H=-692.0 kJ/mol;
(5)稀释会促进弱电解质的电离,故若取pH、体积均相等的NaOH和氨水分别加水稀释m倍、n稀释后pH仍相等,则氨水稀释倍数大,故答案为:<.
点评 本题综合考查了盐类水解,水的电离,热化学方程式的书写等知识点.根据平衡移动原理即可顺利解题,比较容易.


科目:高中化学 来源: 题型:选择题
| 序号 | 名 称 | 抑酸成分 | 主要成分含量/片 |
| ① | INDICALM | CaCO3 | 250mg |
| ② | Stamachease | Al(OH)3 | 250mg |
| ③ | Fash digestion | MgO | 250mg |
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
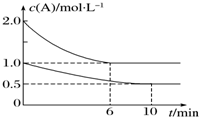 在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )
在容积均为1L的甲、乙两个恒容容器中,分别充入2mol A、2mol B和1mol A、1mol B,相同条件下,发生下列反应:A(g)+B(g)?xC(g)△H<0.测得两容器中c(A)随时间t的变化如图所示,下列说法错误的是( )| A. | 甲和乙中A的平衡转化率相等 | |
| B. | 给甲容器加压可缩短反应达到平衡的时间 | |
| C. | 给乙容器升温可缩短反应达到平衡的时间 | |
| D. | 甲容器中A的反应速率为0.1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、苛性钠、偏铝酸钠 | B. | 硅酸、乙醇、小苏打 | ||
| C. | 硫酸、纯碱、硅酸钠 | D. | 碳酸、烧碱、一水合氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
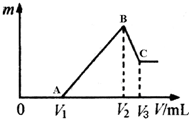 将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 4mol/LHCl溶液中,然后再滴加1mol/L NaOH溶液.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有$\frac{1}{2}$NA个硫原子被还原 | B. | 有$\frac{1}{3}$NA个氮原子被氧化 | ||
| C. | 有$\frac{3}{4}$NA个二氧化硫分子生成 | D. | 有$\frac{2}{3}$NA个硫酸铵分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com