
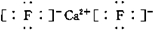 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.
分析 (1)一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,同种非金属形成非极性键,不同非金属形成极性键;
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,为CaF2;若XY2为共价化合物时,为CS2;
(3)氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,可知熔沸点低,与分子晶体的性质相似;
(4)由元素的位置可知,a为H,b为Na,c为Mg,d为出,e为N,f为P,g为Cl,
①一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键;
②所有原子都满足最外层为8电子结构,不含H,化合物中中心元素的族序数+成键数=8可满足题意.
解答 解:(1)①O2中只含共价键,为单质;
②H2中只含共价键,为单质;
③NH4NO3中含离子键和极性键,为离子化合物;
④K2O2中含离子键和非极性键,为离子化合物;
⑤Ba(OH)2中含离子键和极性键,为离子化合物;
⑥CH4中含极性键,为共价化合物;
⑦CO2中含极性键,为共价化合物;
⑧NaF中只含离子键,为离子化合物;
⑨NH3中含极性键,为共价化合物;
⑩I2中只含共价键,为单质,
则既有离子键又有非极性键的是④;既有离子键又有极性键的是③⑤,故答案为:④;③⑤;
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,为CaF2,其电子式为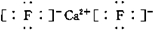 ;若XY2为共价化合物时,为CS2,其结构式为S=C=S,故答案为:
;若XY2为共价化合物时,为CS2,其结构式为S=C=S,故答案为: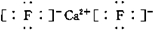 ;S=C=S;
;S=C=S;
(3)氯化铝的熔点为190℃(2.02×103 Pa),但在180℃就开始升华,可知熔沸点低,与分子晶体的性质相似,可知由共价键形成的共价化合物,可利用熔融状态下不能导电来实验证明,
故答案为:共价化合物;熔融状态下不能导电;
(4)由元素的位置可知,a为H,b为Na,c为Mg,d为出,e为N,f为P,g为Cl,
①元素的原子间反应最容易形成离子键的是b和g(NaCl),容易形成共价键的是d和g(CCl4),故答案为:B;C;
②所有原子都满足最外层为8电子结构,不含H,化合物中中心元素的族序数+成键数=8可满足题意,则所有原子都满足最外层为8电子结构的任意一种分子的分子式为CCl4(或PCl3),故答案为:CCl4(或PCl3).
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| 离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
| 开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
| 完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
| A. | 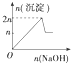 | B. | 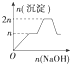 | C. |  | D. | 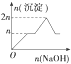 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
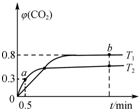 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: | ||
| C. | 铝原子的结构示意图: | D. | 二氧化碳的结构式:O-C-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| B. | 向淀粉溶液中加入稀H2SO4,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解 | |
| C. | 将蔗糖和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖 | |
| D. | 蛋白质溶液中加入丙酮可以使蛋白质从溶液中析出,再加水又能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | C、D、E的半径:C>D>E | |
| D. | 化合物AE与CE有相同类型的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com