
【题目】下列有关有机化合物的说法正确的是
A. 麦芽糖的水解产物有两种,且互为同分异构体
B. 等质量的苯和苯乙烯完全燃烧,消耗氧气的体积在相同条件下不相同
C. 间二甲苯中苯环上的一个氢原子被“![]() ”取代时,有9种结构(不考虑立体异构)
”取代时,有9种结构(不考虑立体异构)
D. ![]() 与甲苯或甘油在一定条件下发生反应,其反应类型不同
与甲苯或甘油在一定条件下发生反应,其反应类型不同
【答案】C
【解析】
A. 麦芽糖的水解产物只有葡萄糖一种,A项错误;
B. 等质量的有机物完全燃烧时,消耗氧气的量的多少由y/x或氢的质量分数来决定,该值越大,耗氧量越多,因苯与苯乙烯分子中氢的质量分数相同,则耗氧量在相同条件下相同,B项错误;
C. “间二甲苯”中苯环上有3种氢原子,“-C2H3Cl2” 由3种结构:-CH2CHCl2、-CHClCH2Cl、-CCl2CH3,因此“间二甲苯”中苯环上的一个氢原子被“-C2H3Cl2” 取代时,形成的同分异构体有3×3=9种,C项正确;
D. 硝酸与甲苯在浓硫酸作用下发生硝化反应,属于取代反应;硝酸与甘油发生酯化反应,也属于取代反应,其反应类型相同,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】根据要求答题
(一)现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl ⑧冰水混合物 ⑨碳酸钙 ⑩CuSO4·5H2O。
(1)上述物质中属于电解质的有__________(填序号)。
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为______________________________。
(二)(1)某气态氧化物化学式为RO2,在标准状况下,1.28 g该氧化物的体积是448 mL,则氧化物的摩尔质量为_______,R的相对原子质量为__________。
(2)在标准状况下,w L氮气含有x个N2分子,则阿伏加德罗常数为____________(用w,x表示)。
(3)过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的BaCl2溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量盐酸,平衡逆向移动,c(OH-)增大
D.将水加热,Kw增大,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钙材料具有良好的透光性和较低的折射率,可用做紫外和红外光学元件、不可见光谱范围内的消色差镜头。如图为氟化钙晶胞,其中小球代表Ca2+,大球代表F-。
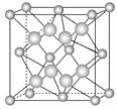
(1)每个晶胞实际含有________个Ca2+和________个F-。
(2)氟化钙晶体可以看作Ca2+按__________堆积排列,F-填入Ca2+堆积的部分空隙中。每个Ca2+周围有__________个F-,而每个F-周围有_________个Ca2+,每个F-周围与其距离最近的F-的数目是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。

(1)元素Ga在元素周期表中的位置为:___(写明周期和族)。
(2)Sn的最高正价为___,Cl的最高价氧化物对应水化物的化学式为___,As的气态氢化物为___。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是___(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4___H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O___H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找___(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为___。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。下列说法正确的是___(填字母)。
A.原子半径:In>Se
B.In的金属性比Se强
C.In的金属性比Al弱
D.硒化铟的化学式为InSe2
③工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HClO氧化为H2SeO3及CuCl2,反应中HClO与Cu2Se的物质的量之比为___。
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入___,再加入___,将生成气体通过___洗气后,通入___; | 现象:___;结论:非金属性C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示晶体结构是一种具有优良的电压、电光等功能的晶体材料的最小结构单元(晶胞).晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带电荷均已略去)( )
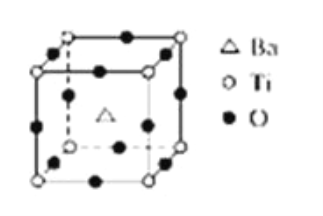
A. 8;BaTi8O12
B. 8;BaTi4O9
C. 6;BaTiO3
D. 3;BaTi2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)用双线桥法表示电子转移方向和数目_____:①MnO2 +4HCl(浓)=== Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为__(填化学式),被氧化的物质的量为 _____,同时转移电子数为_____。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_____L,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。(已知:H2+Cl2![]() 2HCl)
2HCl)
(4)②KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2 ![]() 2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由弱到强的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到_____g固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度淡水。由此可判断蒸馏法是________________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐________ t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:______,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
A. 当有6 NA个电子转移时,该反应放出1300 kJ的能量
B. 当有1NA个水分子生成且为液体时,吸收1300 kJ的能量
C. 当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com