
【题目】pH=12的NaOH和pH=4的HCl等体积混合的pH=_____________
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(7分)某含有一个双键的气态烯烃和另一气态烷烃的混合气体,在同温同压下其密度是H2的13.2倍。在标准状况下将4.48L混合气体通过足量的溴水,结果溴水增重3.36g,求原混合气体中各烃的体积分数。 (注:此题必须写出过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,![]() 二元弱酸
二元弱酸![]() (或其钠盐)用相同浓度的
(或其钠盐)用相同浓度的![]() 溶液(或盐酸)滴定,其
溶液(或盐酸)滴定,其![]() 与滴定分数
与滴定分数![]() 的关系如下图所示:下列说法正确的是( )
的关系如下图所示:下列说法正确的是( )
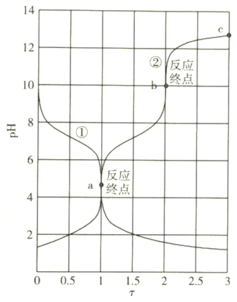
A.曲线①表示盐酸滴定![]() 溶液
溶液
B.25℃时,![]()
C.溶液中:a点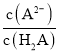 比b点
比b点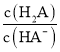 大
大
D.c点溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g) + O2(g)![]() 2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
2NO(g) △H >0,已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是______%(保留整数)。
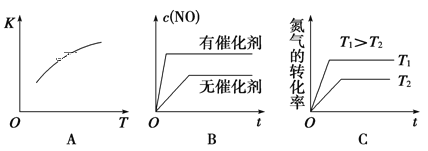
(2)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L 和3.0×10-3mol/L,此时反应__________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是 _______。将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是 ________(填字母序号)。
(3)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数_______(填“变大、“变小”或“不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择性催化还原是在有催化剂的条件下将NOx转变为N2和H2O,这是目前国外硝酸厂进行尾气治理普遍采用的一种方法,某小组同学拟验证NO能被氨气还原并测算其转化率。
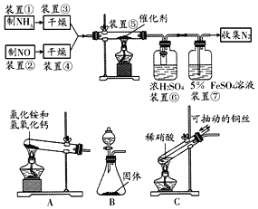
请回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为_______,若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是______、________;
(2)用C装置制取NO时,用可抽动的铜丝,其优点是_______,其反应的离子方程式为________;
(3)装置⑦的作用可能是____________;
(4)若进入装置⑤的NO共2688mL(标况下),氨气过量,最后收集到标况下2016mLN2,则NO的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可如图表示。
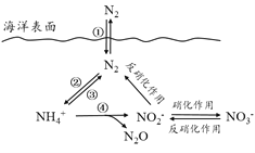
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮 b.海洋中的氮循环起始于氮的氧化c.海洋中的反硝化作用一定有氧气的参与d.向海洋排放含![]() 的废水会影响海洋中
的废水会影响海洋中![]() 的含量
的含量
(3)有氧时,在硝化细菌作用下,![]() 可实现过程④的转化,将过程④的离子方程式补充完整:___
可实现过程④的转化,将过程④的离子方程式补充完整:___![]() +5O2==2
+5O2==2![]() +____H++____+_____
+____H++____+_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用含多糖(淀粉)的物质可以生产醋酸。下面是生产醋酸的流程,根据流程回答下列问题:
![]()
![]()
![]() →
→![]() →
→![]() →
→![]()
B是日常生活中有特殊香味的常见有机物,在有些饮料中含有B。
(1)C中官能团的名称是______________________。
(2)B→C的反应类型是________________(填字母)。
A.取代反应 B.加成反应
C.氧化反应 D.还原反应
(3)写出由醋酸制备醋酸甲酯的化学反应方程式:
_______________________________________________________________________________。
(4)实验室由B可制备乙烯气体,写出将乙烯气体通入溴水中出现的现象:
_______________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以白云石(主要成分为MgCO3 ·CaCO3)为原料制取氢氧化镁的工艺流程如下:

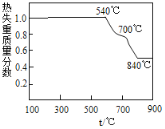
(1)白云石属于_______物(选填“纯净”或“混合”),在轻烧过程中只发生碳酸镁的分解,则依图可判断“轻烧”温度不能超过______℃。“研磨”的目的是_________________。
(2)已知加热过程中硫酸铵与MgO反应生成一种盐、氨气和水。则加入氨水时的化学方程式为________________________。整个流程中能循环利用的是 _________________。
(3)传统工艺制备氢氧化镁是将白云石在高温下分解产生氧化镁和氧化钙再提取,而本工艺采取轻烧,其优点在于___________________、_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com