
【题目】工业上常用如下的方法从海水中提溴:
浓缩海水![]() 粗产品溴
粗产品溴![]() 溴蒸气
溴蒸气![]() 物质X
物质X![]() 产品溴
产品溴
完成下列填空:
(1)上述流程中有两步都涉及到氯气。写出氯元素在周期表中的位置:_______;足量氯气与铁反应生成氯化铁,足量碘与铁反应生成碘化亚铁。运用原子结构和元素周期律简要说明导致产物中铁元素价态不同的原因________。
(2)和氯元素位于同主族的另外一个短周期元素单质的电子式是:___,两者气态氢化物的稳定性是:_______>_______(填写化学式)。
(3)步骤②中体现了溴具有的性质是_______(文字简述)。
(4)写出步骤③中反应的离子方程式(说明:此反应在水溶液中进行):_______;
(5)溴蒸汽还可以用饱和碳酸钠溶液来吸收,产物为NaBr、NaBrO3,同时放出CO2,请写出该反应的化学方程式并标明电子转移方向与数目:_______。
(6)用上述方法制得的液溴常溶有少量氯气,除去氯气的方法是_______。
【答案】第三周期第ⅦA族 氯和碘处于同一主族,原子最外层都有7个电子,由于碘原子电子层数比氯多,原子核对最外层电子吸引力弱,所以碘得电子能力弱,单质的氧化性比氯弱,无法将铁元素氧化到+3价 ![]() HF HCl 沸点低,易挥发 Br2+SO2+2H2O=4H++SO42-+2Br-
HF HCl 沸点低,易挥发 Br2+SO2+2H2O=4H++SO42-+2Br- ![]() 加入溴化钠溶液,搅拌,静置,分液
加入溴化钠溶液,搅拌,静置,分液
【解析】
浓缩后增大溴离子的浓度,与氯气发生2Br-+C12=Br2+2Cl-,用空气和水蒸气将溴吹出,并用SO2吸收,从而达到富集溴,③中发生Br2+2H2O+SO2=2HBr+H2SO4,④中发生Cl2+2HBr=Br2+2HCl;
(1)根据元素的原子结构与元素在周期表的位置书写,根据同族元素性质的递变性分析;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,非金属性越强氢化物稳定性越强;
(3)步骤②中体现了溴具有的性质是易挥发性;
(4)步骤③中反应是发生Br2+2H2O+SO2=2HBr+H2SO4,将其改写为离子方程式;
(5)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,根据氧化还原反应的规律标注电子转移情况;
(6)根据非金属元素单质间的置换反应除去杂质。
(1)氯元素核电荷数17,原子核外三个电子层,最外层电子数7个,所以Cl元素在周期表的位置位于周期表中第三周期第ⅤⅡA。由于氯和碘处于元素周期表中同一主族,原子最外层都有7个电子,但由于碘原子电子层数比氯原子多,原子核对最外层电子吸引力弱,使得碘得电子能力弱,单质的氧化性比氯弱,只能将Fe氧化为+2价的Fe2+,无法将铁元素氧化到+3价;
(2)和氯元素位于同主族的另外一个短周期元素单质为F2,氟原子间形成一对共用电子对,使分子中每个F原子都达到最外层8个电子的稳定结构,其电子式为![]() ;非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl;
;非金属性越强氢化物稳定性越强,两者气态氢化物的稳定性是HF>HCl;
(3)步骤②中用空气和水蒸气将溴吹出,并用SO2将Br2蒸气吸收,从而达到富集溴的目的,这体现了溴具有的性质是沸点低,易挥发的特点;
(4)步骤③中反应是溴单质和二氧化硫在水溶液中发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:Br2+SO2+2H2O=H2SO4+2HBr,将其改写为离子方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-;
(5)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的化学方程式为:3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,在该反应中,溴元素0价变化为-1价和+5价,电子转移总数5e-,该反应的化学方程式并标明电子转移方向与数目为:![]() ;
;
(6)由于氧化性Cl2>Br2,所以用上述方法制得的液溴常溶有少量氯气,除去其中氯气的方法是向其中加入溴化钠溶液,充分搅拌,发生反应:Cl2+2NaBr=2NaCl+Br2,然后再静置,分液。


科目:高中化学 来源: 题型:
【题目】(1)在同温同压下,两个体积相同的玻璃密闭容器中分别盛满氮气和氧气,则容器中氮气和氧气的质量之比为___________________________。
(2)在标准状况下,11.2L某氮氧化物NOx气体的质量是23g,则x的值为___________________。
(3)200 mL Fe2(SO4)3溶液中含56g Fe3+,溶液中SO42—的物质的量浓度是___________________。
(4)一定质量的某金属元素R的硝酸盐受热完全分解,反应按下式进行:2R(NO3)2=2RO+4NO2↑+O2↑若得到1mol RO固体,则得到的气体在标准状况下的总体积是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃化合物A,最大质荷比为104,碳的质量分数为92.3%。
(1)A的分子式为___________,相对于氢气的密度为___________;其中核磁共振有____组峰,面积比为:___________;其中最少有________个原子共平面。
(2)A与溴的四氯化碳溶液反应的化学方程式为_______________________;
(3)一定条件下,A与氢气反应,得到的化合物中碳的质量分数为85.7%,写出此化合物的结构简式____________________;
(4)在一定条件下,由A聚合得到的高分子化合物的结构简式为_______________。
(5)B是A 的一种同分异构体,且B的一氯代物只有一种,则B的结构简式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成一种有果香味的物质C和化合物D的合成路线如下图所示。
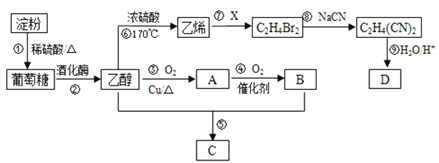
已知:![]()
请回答下列问题:
(1)A的结构简式为____________________,B分子中的官能团名称为__________________。
(2)反应⑦的化学方程式为___________________________,反应⑧的类型为______________。
(3)反应⑤的化学方程式为_____________________________。
(4)已知D的相对分子量为118,有酸性且只含有一种官能团,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D的结构简式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,在恒容密闭容器中NO2与O2反应为4NO2(g)+O2(g)![]() 2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
2N2O5(g)。(不考虑NO2的分解 ) 若已知该反应是放热反应,则K550℃___K350℃,(填“大于” “等于”或“小于”)。反应达平衡后,若再通入一定量NO2,则平衡常数K将_______,NO2的转化率______。(填“增大”“减小”或“不变”)
(2)若初始时在恒容密闭容器中加入N2O5,下表为N2O5分解反应在一定温度下不同时间测得N2O5浓度的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
①写出该反应的平衡常数表达式:K=____________。
②1000s内N2O5的分解速率为:_____________。
③若每有1 mol N2O5分解,吸收Q kJ的热量,写出该分解反应的热化学方程式____。
④能使4NO2(g)+O2(g)![]() 2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
2N2O5(g)反应速率增大,且平衡向正反应方向移动的是(_______)
a.及时分离出N2O5 b.适当提高温度 c.增大O2浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定有机化合物中碳和氢的组成常用燃烧分析法,下图是德国化学家李比希测定有机物组成的装置,氧化铜作催化剂,在750℃左右使有机物在氧气流中全部氧化为CO2和H2O,用含有固体氢氧化钠和氯化钙的吸收管分别吸收CO2和H2O。
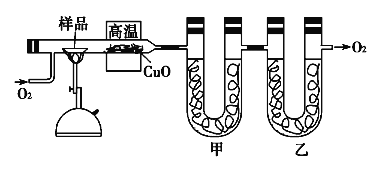
试回答下列问题:
(1)甲装置中盛放的是________,甲、乙中的吸收剂能否颠倒?________。
(2)实验开始时,要先通入氧气一会儿,然后再加热,为什么? _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向100mL 0.1mol·L-1的CH3COOH溶液中逐滴加入0.1mol·L-1的NaOH溶液,所得溶液的pH随加入NaOH溶液的体积V的关系中不正确的是
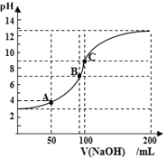
A. A点表示的溶液:c(CH3COO-)>c(Na+)
B. A点溶液中:c(CH3COO-)-c(CH3COOH) =2×(10-4-10-10)mol·L-1
C. B点表示CH3COOH和NaOH恰好反应完全
D. C点溶液促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸式滴定管准确移取25.00 mL某未知浓度的盐酸溶液于一洁净的锥形瓶中,然后用0.2000 molL-1的氢氧化钠溶液(指示剂为酚酞)滴定。滴定结果如下所示:
NaOH溶液起始读数 | NaOH终点读数 | |
第一次 | 0.10 mL | 12.70 mL |
第二次 | 0.00 mL | 12.40mL |
(1)准确配制0.2000 molL-1的氢氧化钠溶液250 mL,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的玻璃仪器有____。
(2)根据以上数据可以计算出盐酸的物质的量浓度为___molL-1。
(3)用0.2000 molL-1标准氢氧化钠溶液滴定待测盐酸溶液,滴定时左手控制碱式滴定管的玻璃球,右手不停摇动锥形瓶,眼睛注视______,直到滴定终点。
(4)达到滴定终点的标志是____。
(5)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是____(填“偏高”或“偏低”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学常见的物质转化如图所示。
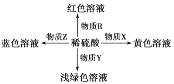
下表中R、X、Y、Z对应物质正确的是( )
选项 | R | X | Y | Z |
A | 紫色石蕊 | Fe2O3 | Fe2O3和Cu | Cu |
B | 甲基橙 | Fe(NO3)2 | Fe(OH)2 | Cu2(OH)2CO3 |
C | 酚酞 | Fe(OH)3 | FeO和Fe | CuO |
D | Fe2O3 | Na[Al(OH)4] | Na2SiO3 | Cu(OH)2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com