
| A. | 2H与3H互为同位素 | B. | 金刚石与石墨互为同素异形体 | ||
| C. | 3O2$\frac{\underline{\;放电\;}}{\;}$2O3是物理变化 | D. | 乙醇与二甲醚互为同分异构体 |
分析 A.质子数相同中子数不同的原子互称同位素,互为同位素原子具有以下特征:质子数相同、化学性质相同、在周期表中的位置相同;中子数不同、质量数不同、物理性质不同;研究对象为原子;
B.同素异形体是同种元素形成的不同单质;
C.同素异形体间的转化是化学变化;
D.具有相同分子式而结构不同的化合物互为同分异构体.
解答 解:A.同位素的特征是质子数相同中子数不同,则2H与3H互为同位素,故A正确;
B.金刚石与石墨互是单质,并且都是由碳元素形成,是同素异形体的关系,故B正确;
C.O2与O3是同种元素形成的不同单质,3O2$\frac{\underline{\;放电\;}}{\;}$2O3是化学变化,故C错误;
D.乙醇与二甲醚分子式相同,结构不同,互为同分异构体,故D正确;
故选:C.
点评 本题考查同位素、同素异形体、同分异构体,题目难度不大,注意把握概念是解决此类题的关键之所在.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
| HA | H2B | HC | ||
| Ka | K${\;}_{{a}_{1}}$ | K${\;}_{{a}_{2}}$ | K${\;}_{{a}_{3}}$ | K${\;}_{{a}_{4}}$ |
| 数值 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
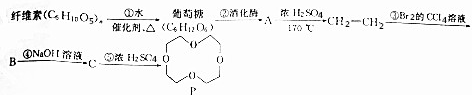
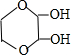 、
、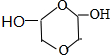 (任写一种)(不考虑立体异构)
(任写一种)(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
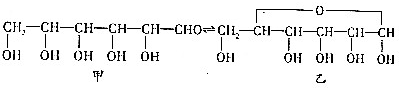
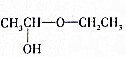 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→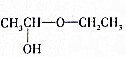 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2≈1.6×10-3 | B. | 2c(Na+)=c(HCN)+c(CN-) | ||
| C. | 混合溶液的pH<7 | D. | 对混合溶液升温,K1增大、K2减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
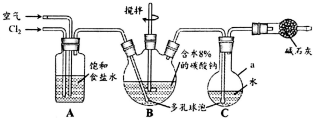 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
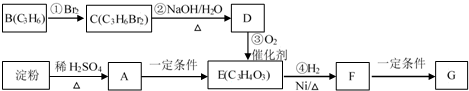
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com