
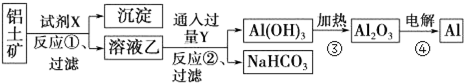
分析 铝土矿(主要成分为Al2O3,只含Fe2O3杂质),根据流程图可知,加入试剂X为氢氧化钠溶液,Fe2O3和氢氧化钠不反应而氧化铝能反应,所以得到沉淀为Fe2O3,溶液乙为偏铝酸钠溶液,向偏铝酸钠溶液中通入过量的Y为二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠溶液,过滤得到氢氧化铝的沉淀,再加热分解得到氧化铝,最后电解得到铝单质,
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)上述反应中反应①②③都是非氧化还原反应,反应①为氧化铝与氢氧化钠反应生成偏铝酸钠和氢气;
(3)根据上面的分析可知,反应 ①后过滤的沉淀为氧化铁,要确定氧化铁中金属元素及其价态,可以用酸溶解,再用KSCN溶液检验铁离子的存在;
(4)I.根据题中流程可知,测定合金样品中铝的质量分数,还需要称量合金样品的质量;
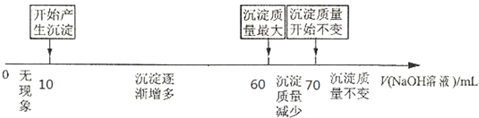
II.当加入60~70ml氢氧化钠溶液时,沉淀的质量减小,是氢氧化铝与氢氧化钠发生反应生成了偏铝酸钠,据此书写离子方程式,加入NaOH溶液50mL~60mL为Al(OH)3与NaOH的反应,可计算Al3+的物质的量,则加入NaOH溶液10mL~50mL为Al3+和Mg2+消耗的体积,根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知Al和Mg的物质的量之比,进而可计算镁的质量分数.
解答 解:铝土矿(主要成分为Al2O3,只含Fe2O3杂质),根据流程图可知,加入试剂X为氢氧化钠溶液,Fe2O3和氢氧化钠不反应而氧化铝能反应,所以得到沉淀为Fe2O3,溶液乙为偏铝酸钠溶液,向偏铝酸钠溶液中通入过量的Y为二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠溶液,过滤得到氢氧化铝的沉淀,再加热分解得到氧化铝,最后电解得到铝单质,
(1)实验室进行过滤用到的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:漏斗;
(2)上述反应中反应①②③都是非氧化还原反应,反应①为氧化铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:否;Al2O3+2NaOH=2NaAlO2+H2O;
(3)根据上面的分析可知,反应 ①后过滤的沉淀为Fe2O3,要确定氧化铁中金属元素及其价态,可以用酸溶解,再用KSCN溶液检验铁离子的存在,操作过程为取少量沉淀于一支洁净试管,加入适量稀硫酸(或盐酸)使其完全溶解,再滴加少量硫氰化钾(或硫氰化铵),若溶液呈(血)红色,说明它为Fe2O3,
故答案为:Fe2O3;取少量沉淀于一支洁净试管,加入适量稀硫酸(或盐酸)使其完全溶解,再滴加少量硫氰化钾(或硫氰化铵),若溶液呈(血)红色,说明它为Fe2O3;
(4)I.灼烧得到的是氧化镁,所以要计算合金中镁的质量分数,还需要称量合金样品的质量,
故答案为:合金样品的质量;
II.当加入60~70ml氢氧化钠溶液时,沉淀的质量减小,是氢氧化铝与氢氧化钠发生反应生成了偏铝酸钠,反应的离子方程式为Al(OH)3+2OH-=2 AlO2-+H2O,根据数轴可知,溶解氢氧化铝消耗的氢氧化钠溶液是70ml-60ml=10ml,则生成氢氧化铝消耗的氢氧化钠溶液体积应该是30ml,所以生成氢氧化镁消耗的氢氧化钠溶液体积是60ml-10ml-30ml=20ml,则根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知Al和Mg的物质的量之比是1:1的,则铝的质量分数是$\frac{27}{27+24}×100%$=52.94%,
故答案为:Al(OH)3+2OH-=2 AlO2-+H2O;能;52.94%.
点评 该题考查镁铝合金中镁质量分数测定探究实验的有关判断,是高考中的常见题型,属于中等难度的试题,试题综合性强,在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力,该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 向稀Fe(NO3)2和NaBr混合溶液加入少量稀盐酸:6Br-+8H++2NO${\;}_{3}^{-}$═3Br2+2NO↑+4H2O | |
| B. | 往NH4Al(SO4)2溶液中滴加Ba(OH)2溶液加热,刚好使NH4+全部转化为NH3:NH4++Al3++SO42-+Ba2+4OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Al(OH)3↓+BaSO4+H2O | |
| C. | 碳酸钠溶液呈碱性:CO32-+2H2O?H2CO3+2OH- | |
| D. | 用氢氧化钠溶液去除铝条表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
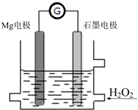 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 石墨电极是该电池的正极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| D. | 电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在0.10mol•L-1CH3COOH溶液中加入少量CH3COONa晶体,能使CH3COOH的电离度降低,溶液的pH增大 | |
| B. | 常温下向氯化铵溶液中加入少量氨水使溶液中c(NH4+)=c(Cl-),则混合液的pH=7 | |
| C. | 已知草酸氢钾溶液呈酸性,则在0.1 mol•L-1KHC2O4溶液中c(C2O42-)>c(K+)>c(H2C2O4) | |
| D. | pH=3的0.1 mol•L-1HA溶液与0.05 mol•L-1NaOH溶液等体积混合后所得溶液中:2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
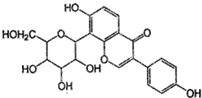
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 一定条件下1mol 该物质与浓溴水反应最多能消耗3mol Br2 | |
| D. | 一定条件下1mol 该物质与H2反应最多能消耗7mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
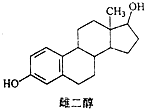
| A. | 能与Na、Na0H溶液、Na2CO3溶液反应 | |
| B. | 能发生加成反应、取代反应、消去反应 | |
| C. | 该分子中所有碳原子不可能在同一个平面内 | |
| D. | 可与FeC13溶液发生显色反应,但不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
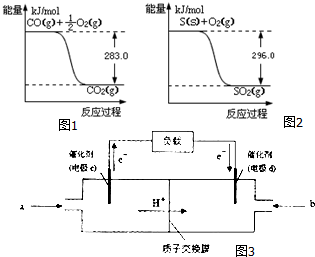 一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资
一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资查看答案和解析>>
科目:高中化学 来源: 题型:多选题
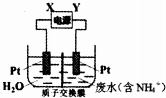
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com