
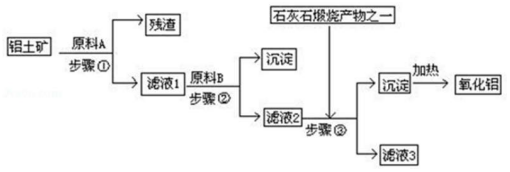
分析 铝土矿的主要成分是Al2O3,还有少量的Fe2O3、SiO2,由流程可知,原料A为盐酸,SiO2和盐酸不反应,Al2O3、Fe2O3均与盐酸反应,步骤①分离不溶固体与液体,为过滤操作,得到残渣为SiO2,滤液1含有AlCl3、FeCl3及剩余的HCl,加入试剂B得到沉淀与滤液2,步骤②为过滤,步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,所以滤液②含有AlO2-,步骤②应加入原料B为NaOH,将Fe3+转化为Fe(OH)3沉淀,将Al3+转化为AlO2-,氢氧化铝加入分解得到氧化铝,据此分析解答.
解答 解:(1)SiO2和盐酸不反应,Al2O3、Fe2O3均与盐酸反应,步骤①分离不溶固体与液体,为过滤操作,得到残渣为SiO2,过滤需要的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:SiO2;过滤;漏斗;
(2)滤液②含有AlO2-,步骤③通入过量的二氧化碳,与AlO2-反应生成的沉淀为氢氧化铝,反应进行方程式为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤沉淀得到的滤液主要成分为NaHCO3,离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
故答案为:碳酸氢钠;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)如果省去步骤①,即溶解铝土矿是从加入原料B开始,用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,通入二氧化碳会生成硅酸沉淀,最后使加热制得的Al2O3混有SiO2杂质;
故答案为:若用NaOH溶液溶解铝土矿,则有部分SiO2溶解在NaOH溶液中生成硅酸钠,最后使加热制得的Al2O3混有SiO2杂质;
(4)向AlCl3溶液中加入氨水来制取Al(OH)3,反应的离子方程为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
点评 本题以框图题形式考查化学工艺流程、物质的分离提纯、铝的化合物的性质,难度中等,是对知识迁移的综合运用.


科目:高中化学 来源: 题型:选择题
| A. | 向该溶液中加入pH=3的盐酸溶液,溶液的pH值减小 | |
| B. | 向该溶液中加入蒸馏水,CH3COOH和水的电离程度均增加 | |
| C. | CH3COOH(aq)?CH3COO-(aq)+H+(aq),Ka=1.0×10-5 | |
| D. | 0.1mol/L的CH3COONa溶液,溶液的pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g由葡萄糖和冰醋酸组成的混合物中含有的原子总数为0.3NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液中含有的氮原子数小于0.1NA | |
| C. | 用铅蓄电池电解氯化钠溶液,得到标准状况下22.4L氢气时,理论上铅蓄电池中消耗氢离子数目为4NA | |
| D. | 氢气与氯气反应生成标准状况下22.4L氯化氢,断裂化学键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
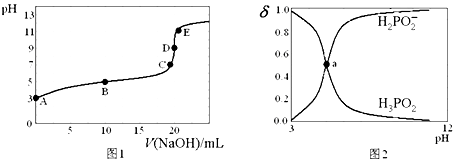
| A. | H3PO2的电离方程式为H3PO2?H2PO2-+H+ Ka≈10-5 | |
| B. | B点时,溶液中存在关系:2c(H+)+c(H2PO2-)═2c(OH-)+c(H3PO2) | |
| C. | C点时,溶液中存在关系:c(Na+)+c(H+)═c(H2PO2-)+c(OH-) | |
| D. | D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
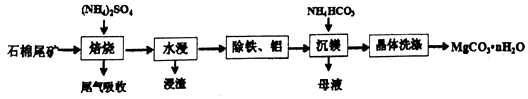
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27g铝中加入lmol/L的NaOH溶液,转移电子数是3NA | |
| B. | 56gN2与CO混合物中原子总数是4NA | |
| C. | 标准状况下,44.8LNO与22.4LO2反应后的分子数是2NA | |
| D. | 常温下,1LpH=l的H2SO4溶液中的H+为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素符号 | A | B | C | D | E |
| 电负性 | 3.0 | 2.5 | X | 1.5 | 0.9 |
| 原子半径(单位nm) | 0.099 | 0.102 | 0.110 | 0.143 | 0.186 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
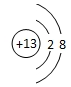 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL 10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙烯中所含的C-H 键数目为2NA | |
| D. | 0.1 mol NH3中所含的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com