
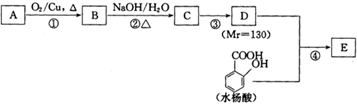
| NaOH/H2O |
| △ |
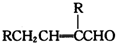
| 反应物1 |
| 反应条件1 |
| 反应物2 |
| 反应条件2 |
| 16 |
| 21.6% |
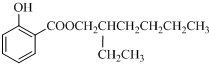 ,结合物质的结构和性质解答.
,结合物质的结构和性质解答.| 16 |
| 21.6% |
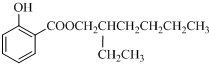 ,
,| △ |
| △ |
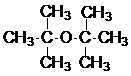 ,
,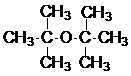 ;
;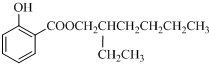 ,故答案为:
,故答案为: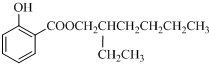 ;
;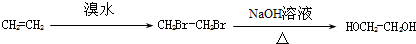 ,
,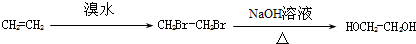 .
.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
| A、电解氯化镁溶液:Mg2++2Cl-═Mg+Cl2↑ |
| B、碳酸镁悬浊液中加醋酸:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
| C、酸性K2Cr2O7溶液可氧化双氧水H2O2:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O |
| D、氨水溶解氯化银沉淀的原理:AgCl+2 NH3?H2O=[Ag(NH3)2]++Cl-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 预期实验目的或结论 |
| A | 室温下,用pH试纸测定浓度为0.1mol?L-1 Na2SiO3溶液和Na2CO3溶液的pH | 比较H2SiO3和H2CO3的酸性强弱 |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 将某气体通入淀粉和KI的混合溶液,溶液变蓝色 | 该气体一定是Cl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com