
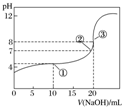
| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |
分析 A.在酸碱中和滴定的实验中,一般不用石蕊作指示剂,主要原因是:石蕊的“红色→紫色”、“紫色→蓝色”的颜色变化不够明显;
B.-①点时溶液显示酸性,氢离子抑制了水的电离,而在③点醋酸和氢氧化钠恰好反应生成醋酸钠,醋酸根离子水解促进了水的电离;
C.根据电荷守恒分析;
D.在②处溶液的pH=7,溶液显示中性,根据电荷守恒可以判断c(CH3COO-)=c(Na+).
解答 解:A.中和滴定中,由于其颜色变化不明显,一般不选用石蕊作指示剂,主要原因是:石蕊的“红色→紫色”、“紫色→蓝色”的颜色变化不够明显,不利于及时、准确地作出酸碱是否恰好完全中和的判断,可以选用酚酞作指示剂,故A错误;
B.图中点①所示溶液中,氢离子抑制了水的电离,导致水的电离程度减小,而在点③所示溶液中,溶质为醋酸钠,醋酸根离子水解促进了水的电离程度,所以水的电离程度:①<③,故B错误;
C.若溶液中离子浓度存在c(Na+)>c(CH3COO-)>c(H+)>c(OH-),则c(Na+)+c(H+)>c(CH3COO-)+c(OH-),不满足电荷守恒,故C错误;
D.图中点②所示溶液中,溶液显示中性,则c(OH-)=c(H+),根据电荷守恒可知:c(CH3COO-)=c(Na+),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断及溶液中离子浓度大小比较,明确图象中酸碱混合时溶液中的溶质是解答本题的关键,注意电荷守恒、物料守恒、盐的水解等在比较离子浓度大小中的应用方法.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:多选题
| A. | BaSO4的电离程度减小 | B. | BaSO4溶解的量减小 | ||
| C. | c(Ba2+)与c(SO42-)的乘积增大 | D. | 溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
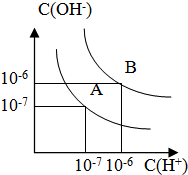 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
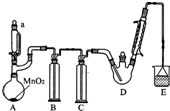 某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验.查阅资料,有关信息如下:| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY | B. | XY2 | C. | XY4 | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl=NH4++Cl- | B. | NaHSO4=Na++HSO42- | ||
| C. | H2CO3=2H++CO32- | D. | CH3COOH→CH3++COOH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com