
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:

实验室用干燥而纯浄的二氧化硫和氯气合成硫酰氯,反应的热化学方程式为:SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1
SO2Cl2(l) △H=-97.3 kJ· mol-1
反应装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器B的名称为________;
(2)仪器A的作用是_______;
(3)装置乙中盛放的试剂为______,在实验室用氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为______;
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有_______(填序号);
①先通冷凝水,再通气体 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①分解产物中分离出硫酰氯的实验操作名称为____。
②某同学为检验硫酰氯产品中是否混有硫酸设计实验如下:取少量产品溶于水,加入盐酸酸化的氯化钡溶液,振荡,观察到有白色沉淀生成,则认为产品中含有硫酸。该同学的结论是否正确,请说明理由____。
【答案】球形干燥管 冷凝回流 浓硫酸 SO2Cl2+4OH-=SO42-+2Cl-+2H2O ①②③ 蒸馏 不正确,因为硫酰氯水解可产生硫酸
【解析】
(1)仪器B的名称为球形干燥管。
(2)仪器A是冷凝管,作用是冷凝回流。
(3)浓硫酸具有吸水性,氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为:SO2Cl2+4OH-=SO42-+2Cl-+2H2O。
(4)SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1,正反应为放热反应,升温平衡左移,为了提高本实验中硫酰氯的产率,不能加热三颈烧瓶。
SO2Cl2(l) △H=-97.3 kJ· mol-1,正反应为放热反应,升温平衡左移,为了提高本实验中硫酰氯的产率,不能加热三颈烧瓶。
(5)①二者为互溶液体,沸点相差较大,采取蒸馏法进行分离。
②硫酰氯水解可产生硫酸,同样能观察到有白色沉淀生成。
(1)仪器B的名称为球形干燥管,故答案为:球形干燥管。
(2)仪器A是冷凝管,作用是冷凝回流,故答案为:冷凝回流。
(3)由KClO3和浓盐酸反应制得的Cl2中混有HCl和水蒸气,丙中盛放饱和NaCl溶液除去HCl,浓硫酸具有吸水性,装置乙中盛放的试剂为浓硫酸,干燥Cl2,氢氧化钠溶液吸收多余硫酰氯的离子反应方程式为:SO2Cl2+4OH-=SO42-+2Cl-+2H2O,故答案为:浓硫酸;SO2Cl2+4OH-=SO42-+2Cl-+2H2O。
(4)SO2(g)+Cl2(g)![]() SO2Cl2(l) △H=-97.3 kJ· mol-1,正反应为放热反应,升温平衡左移,为了提高本实验中硫酰氯的产率,不能加热三颈烧瓶,故答案为:①②③。
SO2Cl2(l) △H=-97.3 kJ· mol-1,正反应为放热反应,升温平衡左移,为了提高本实验中硫酰氯的产率,不能加热三颈烧瓶,故答案为:①②③。
(5)①二者为互溶液体,沸点相差较大,采取蒸馏法进行分离,故答案为:蒸馏;
②硫酰氯水解可产生硫酸,同样能观察到有白色沉淀生成,故答案为:不正确,因为硫酰氯水解可产生硫酸。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】雾霾严重危害人类健康和生态环境,开发稳定高效的脱硫脱硝工艺技术是国内外研究的热点。研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。

(1)NH3的电子式是_________。
(2)NH4NO3溶液中的离子浓度由大到小顺序是_________。
(3)①已知:SO2生成SO3总反应方程式是
2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol
2SO3(g) ΔH=-196.6 kJ/mol
此反应可通过如下两步完成:
2NO(g)+O2 (g ) ![]() 2NO2(g) ΔH1=-113 kJ/mol
2NO2(g) ΔH1=-113 kJ/mol
NO2(g)+SO2(g) ![]() SO3(g)+NO(g) ΔH2=_________。
SO3(g)+NO(g) ΔH2=_________。
② 一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO2和NO的浓度之比为1∶3,则NO2的平衡转化率是_________。
(4)利用NaClO2/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。
① 制备少量NaClO2,其装置如下图所示:

装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应的离子方程式是_____________________________________________,
装置Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是_______________,反应后溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子是_______________。
② 用制得的NaClO2/H2O2酸性复合吸收剂同时对NO、SO2进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液pH对脱硫脱硝的影响如下图所示:


从上图中可知脱硫脱硝最佳条件是_________。图 中SO2的去除率随pH的增大而增大,而NO 的去除率在pH>5.5时反而减小,请解释NO去除率减小的可能原因是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳九芳烃是一种混合物,异丙苯就是其中的一种。工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下。下列有关说法正确的是
![]()
A. a的同分异构体有7种B. a能发生取代反应、加成反应和氧化反应
C. b的分子式为![]() D. b、c互为同系物
D. b、c互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。

已知:

回答下列问题:
(1)A的系统命名为________________。
(2)C的结构简式为 ____________。
(3)B到C的反应类型是________________。
(4)C+D→E的化学反应方程式为________ 。
(5)F的分子式为____________。
(6)G与A互为同分异构体,请写出满足下列条件的任意两种G的结构简式______________。
①核磁共振氢谱显示G分子中有4个吸收峰;
②红外光谱显示G分子中含有苯环、甲氧基(![]() ),没有羟基、过氧键(-O-O-)
),没有羟基、过氧键(-O-O-)
(7)设计以![]() 和
和![]() 为原料制备Y(
为原料制备Y( )的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
)的合成路线(用流程图表示,无机试剂任选)_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应H2(g)+ I2(g)![]() 2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
2HI(g),1 mol H2完全反应放出a kJ的热量,依据下表数据,以下说法错误的是( )
化 学 键 | H—H | I—I |
断开1 mol化学键时吸收的能量(kJ) | b | c |
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H-H 键和1 mol I-I 键所需能量大于断开2 mol H-I 键所需能量
C.断开2 mol H-I键所需能量为(a+b+c)kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)浙江大学用甲醇、CO、O2在常压、某温度和催化剂的条件下合成碳酸二甲酯(CH3OCOOCH3)的研究开发。已知:
①1mol CO完全燃烧放出283.0kJ的热量;
②1mol H2O(l)完全蒸发变成H2O(g)需吸收44.0 kJ的热量;
③2CH3OH(g)+CO2(g) ![]() CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
CH3OCOOCH3(g)+H2O(g) ΔH=-15.5 kJ·mol-1
则2CH3OH(g)+CO(g)+1/2O2(g)![]() CH3OCOOCH3(g)+H2O(l) ΔH=__________。
CH3OCOOCH3(g)+H2O(l) ΔH=__________。
(2)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)是一个放热的可逆反应,反应条件是高温、高压并且需要合适的催化剂。已知形成1mol H—H键、1mol N—H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
2NH3(g)是一个放热的可逆反应,反应条件是高温、高压并且需要合适的催化剂。已知形成1mol H—H键、1mol N—H键、1mol N≡N键放出的能量分别为436 kJ、391 kJ、946 kJ。则:
①若1 mol氮气完全反应生成氨气可放出的能量为__________kJ。
②如果将1 mol氮气和3 mol氢气混合,使充分反应,反应放出的能量总小于上述数值,为什么?__________。
③实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10分钟后,生成10 mol 氨气,则用氮气表示的化学反应速率是__________mol·L-1·min-1。
④一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是__________。
a.以同一物质表示的正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.氮气的转化率达到最大值
d.氮气和氢气的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A. 20 mL 2 mol/L FeCl3溶液 B. 40 mL 1 mol/L NaHCO3溶液
C. 20 mL 1 mol/L Na2SO3溶液 D. 40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了制取纯净干燥的气体A,可用如图所示装置,生成A的速度可通过滴入液体B的速度控制,已知A是一种无色、无味、不能使酸碱指示剂变色、也不会在空气中燃烧的气体,但能使带火星的木条复燃。

(1)A是________。
(2)若C是一种淡黄色固体,则烧瓶中发生反应的化学方程式是_______________________。
(3)若C是一种黑色粉末,则B物质是________,C物质的作用是__________________。
(4)洗气瓶(广口瓶)中装的试剂D是________,其作用是_______。所制得的气体用________法收集。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4![]() 6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
6H2O易溶于水,其溶解度随温度升高明显增大。以电镀废渣(主要成分是NiO,还有CuO、FeO等少量杂质)为原料制备该晶体的流程如下,下列说法错误的是
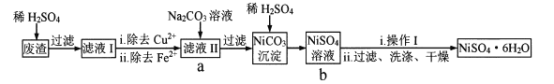
A. 溶解废渣时不能用稀盐酸代替稀H2SO4B. 除去Cu2+可采用FeS
C. 流程中a-b的目的是富集NiSO4D. “操作I”为蒸发浓缩、冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com