
| A. | W2-、X+ | B. | X+、Y3+ | C. | X+、Z2- | D. | Y3+、Z2- |
分析 W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,由选项可知离子所带电荷,结合原子序数判断出具体的元素,再分析.W2-、X+、Y3+、Z2-,、
解答 解:W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,由选项可知离子分别为W2-、X+、Y3+、Z2-,则WZ为第VIA族,W的原子序数小,则W为O,Z为S,XY在O、S之间,则X为Na、Y为Al,其中S2-、Al3+水解能促进水的电离;即Y3+、Z2-能促进水的电离;
故选D.
点评 本题考查位置性质关系,结合离子所带电荷判断出具体的离子是解题的关键,注意理解水的电离平衡的影响因素,需要学生熟练掌握,难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 点燃镁、铝前应用砂纸打磨,除去表面的氧化膜 | |
| B. | 用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来 | |
| C. | 铁在氧气中燃烧的产物主要成分是Fe2O3 | |
| D. | 金属单质在自然界中都以化合物存在,因为它们都有较强的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 银片为正极,发生的反应为:Ag++e-=Ag | |
| B. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| C. | 取下盐桥,原电池仍可工作 | |
| D. | 在外电路中,电子从正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不可能含共价键 | B. | 共价化合物中可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③ | C. | ②③ | D. | ①②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
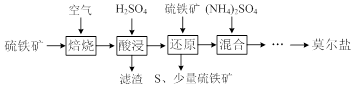
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第15列元素原子的最外层电子排布为ns2 np5 | |
| B. | 只有第二列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第9列元素是铁元素 | |
| D. | 第9列中元素中没有非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com