
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组针对亚硝酸钠设计了如下实验:
【实验Ⅰ】制取NaNO2
该小组先查阅资料知:①2NO+Na2O2 →2NaNO2;2NO2+Na2O2 →2NaNO3;②NO能被酸性高锰酸钾氧化为NO3-,然后设计制取装置如下图(夹持装置略去):

(1)装置A中用于盛放稀HNO3溶液的仪器名称为________;写出装置A中发生主要反应的离子方程式:__________。
(2)装置D的作用是____________;
(3)如果没有B装置,C中发生的副反应的化学方程式①_______ 、②______。
(4)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。下列哪种方案可以提高NaNO2纯度________。
A.将B中的药品换为碱石灰 B.将稀硝酸换为浓硝酸
C.实验开始前通一段时间CO2 D.在A、B之间增加盛有水的洗气瓶
【实验Ⅱ】测定NaNO2样品中NaNO3的含量
步骤:(1)配置KMnO4标准溶液并酸化,酸化KMnO4的酸应选择________(填化学式)
(2)已知在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定亚硝酸钠的含量,称取4.000 g样品溶于水配成250 mL溶液,取25.00 mL溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,消耗KMnO4 20.00mL,酸性KMnO4的作用是______和_______,计算所得固体中亚硝酸钠的质量分数__________。(结果保留一位小数)
【扩展实验Ⅲ】该学习小组为再了解氧族元素的一些典型化合物的性质,进行了如下实验探究。
经查知:硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分 可能是SO2、SO3和O2中的一种、两种或三种。他们通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如图所示:

(1)提出猜想
①所得气体的成分可能只含________一种;
②所得气体的成分可能含有________两种;
③所得气体的成分可能含有SO2、SO3和O2三种。
(2)实验探究
实验操作过程(略)。已知实验结束时,硫酸铜完全分解。
请回答下列问题:
①请你组装探究实验的装置,按从左至右的方向,则仪器接口的连接顺序为______ (填序号)。
②由于加热时的温度不同,实验结束后测得相关数据也不同。数据如下:
实验 | 称取CuSO4的质量/g | 仪器C 增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
第一组 | 6.4 | 2.88 | 224 |
第二组 | 6.4 | 2.56 | 448 |
请通过计算,推断出第一组和第二组的实验条件下CuSO4分解反应的化学方程式:
第一组_________________; 第二组_________________。
【答案】 分液漏斗 3Cu+8H++2NO3-=3Cu2++4H2O+2NO 吸收过量余的NO 2Na2O2+2H2O=4NaOH+O2↑ 2NO+O2=2NO2 AD H2SO4 氧化剂 指示剂 86.3% SO3 SO2、O2 ①③④⑥⑤② 4CuSO4![]() 2SO3↑+2SO2↑+O2↑+4CuO 2CuSO4
2SO3↑+2SO2↑+O2↑+4CuO 2CuSO4![]() 2SO2↑+O2↑+2CuO
2SO2↑+O2↑+2CuO
【解析】【实验I】(1)根据图示,装置A中用于盛放稀HNO3溶液的仪器是分液漏斗;装置A中稀硝酸与铜反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++4H2O+2NO,故答案为:分液漏斗;3Cu+8H++2NO3-=3Cu2++4H2O+2NO;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,装置D可将剩余的NO氧化成NO3-,吸收多余的NO,故答案为:吸收多余的NO;
(3)如果没有B装置,C中发生的副反应有,金属铜和稀硝酸制得的一氧化氮中含有水,水会和过氧化钠发生反应产生氧气,2Na2O2+2H2O=4NaOH+O2↑,生成的氧气极易把一氧化氮氧化为二氧化氮,即2NO+O2=NO2,故答案为:2Na2O2+2H2O=4NaOH+O2↑、2NO+O2=NO2;
(4)由于获得一氧化氮所用的硝酸具有挥发性,且获得NO的过程中会产生其他氮氧化物。因此提高NaNO2纯度需要除去硝酸气体和其他氮氧化物。A.将B中的药品换为碱石灰可以吸收硝酸气体和氮氧化物,正确;B.将稀硝酸换为浓硝酸,硝酸的挥发性增强,不能除去硝酸气体,错误;C.实验开始前通一段时间CO2不能除去硝酸气体和氮氧化物,错误;D.在A、B之间增加盛有水的洗气瓶可以吸收硝酸气体和氮氧化物,正确;故选AD;
【实验Ⅱ】(1)高锰酸钾具有强氧化性,配置KMnO4标准溶液并酸化,酸化的酸应选择稀硫酸,故答案为:H2SO4;
(2)NO2-可将MnO4-还原为Mn2+,体现了高锰酸钾的强氧化性,滴定终点的现象为滴入最后一滴高锰酸钾溶液,溶液变成紫红色;消耗标准液的体积为20.00mL,25mL样品消耗高锰酸钾的物质的量为0.1000mol/L×0.02L=0.002mol,则250mL样品溶液会消耗高锰酸钾的物质的量为0.002mol×![]() =0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为0.02mol×
=0.02mol,根据化合价变化可得反应关系式:2MnO4-~5NO2-,则4.000g样品中含有亚硝酸钠的物质的量为0.02mol×![]() =0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为:
=0.05mol,质量为69g/mol×0.05mol=3.45g,所以反应后的固体中亚硝酸钠的质量分数为: ![]() ×100%=86.3%,故答案为:氧化剂;指示剂;86.3%;
×100%=86.3%,故答案为:氧化剂;指示剂;86.3%;
【扩展实验Ⅲ】(1)根据硫酸铜分解可能发生两种情况2CuSO4![]() 2CuO+2SO2↑+O2↑或CuSO4
2CuO+2SO2↑+O2↑或CuSO4![]() CuO+SO3↑或者两个反应同时发生,故答案为:①SO3 ;②SO2、O2;
CuO+SO3↑或者两个反应同时发生,故答案为:①SO3 ;②SO2、O2;
(2)①气体的制备和收集按照发生装置→除杂装置→干燥气体→气体吸收装置→排水→测量装置来安装实验仪器,按从左至右的方向,先通过硫酸铜分解生成气体,通过碱石灰吸收二氧化硫和三氧化硫,最后利用排水量气法测定氧气的体积,各仪器接口连接顺序为:①③④⑥⑤②;故答案为:①③④⑥⑤②;
②第一组:设6.4g硫酸铜分解生成的SO3和SO2的物质的量分别为x、y,则有80g/molx+64g/moly=2.88g,x+y=![]() ,解得x=0.02mol,y=0.02mol,又n(O2)=
,解得x=0.02mol,y=0.02mol,又n(O2)= ![]() =0.01mol,所以SO3、SO2、O2三者的物质的量之比为2:2:1,反应的方程式:4CuSO4
=0.01mol,所以SO3、SO2、O2三者的物质的量之比为2:2:1,反应的方程式:4CuSO4![]() 2SO3+2SO2+O2+4CuO;同理,第二组:设6.4g硫酸铜分解生成的SO3和SO2的物质的量分别为x、y,则有80g/molx+64g/moly=2.56g,x+y=
2SO3+2SO2+O2+4CuO;同理,第二组:设6.4g硫酸铜分解生成的SO3和SO2的物质的量分别为x、y,则有80g/molx+64g/moly=2.56g,x+y=![]() ,解得x=0,y=0.04mol,又n(O2)=
,解得x=0,y=0.04mol,又n(O2)= ![]() =0.02mol,所以SO2、O2二者的物质的量之比为2:1,反应的方程式:2CuSO4
=0.02mol,所以SO2、O2二者的物质的量之比为2:1,反应的方程式:2CuSO4![]() 2CuO+2SO2↑+O2↑,故答案为:4CuSO4
2CuO+2SO2↑+O2↑,故答案为:4CuSO4![]() 2SO3↑+2SO2↑+O2↑+4CuO;2CuSO4
2SO3↑+2SO2↑+O2↑+4CuO;2CuSO4![]() 2CuO+2SO2↑+O2↑。
2CuO+2SO2↑+O2↑。


科目:高中化学 来源: 题型:
【题目】控制适合的条件,KI溶液过量,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断正确的是( )
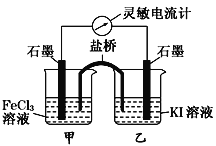
A. 反应开始时,甲中石墨电极为负极,发生氧化反应
B. 反应开始时,乙中石墨电极的反应式:I2+2e- = 2I-
C. 电流计读数为零时,在甲中加入KSCN溶液,出现血红色
D. 电流计读数为零时,反应处在停止状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性HSO3->I-,氧化性IO3-> I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和和析出的I2的物质的量的关系曲线如图。下列说法正确的是

A.反应过程中的氧化产物均为SO3
B.a点时消耗NaHSO3的物质的量为1.0 mol
C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+
D.当溶液中I与I2的物质的量之比为1:1时,加入的NaIO3为1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三组混合物:①氯化钠和水;②硫酸钡和水;③煤油和水。分离以上混合液的操作依次是( )
A. 分液、萃取、蒸馏 B. 蒸发、过滤、分液 C. 分液、蒸发、萃取 D. 蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙.A原子的最外层电子数比次外层电子数多3个.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 , 中子数为14的E原子可表示为 .
(2)写出由A和C形成的化合物的化学式 , 该化合物由键形成.
(3)A、B、C、D、E五种元素的离子半径由小到大的顺序是(用离子符号填写).
(4)写出实验室制取A的气态氢化物的化学方程式: .
(5)简述比较D与E金属性强弱的实验方法: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未完成的离子方程式:( )+XO3-+6H+=3X2+3H2O,据此判断下列说法错误的是
A. X原子最外层电子数为5 B. 当有3molX2生成时,转移5mol电子
C. 氧化产物和还原产物的物质的量之比为5∶1 D. “( )”括号中所填的微粒为X-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃X,相对分子质量为92。以X为原料合成E路线如下(部分产物和反应条件已略去)。
![]()
回答下列问题:
(1)X的结构简式为__________________;C所含的官能团是______________(写名称)。
(2)A→B的反应条件为___________________;D→E的反应类型为_____________________。
(3)C→D转化中①的化学方程式为_________________________________________________。
(4)E在NaOH溶液中水解的化学方程式为__________________________________________。
(5)下列关于B的说法正确的是___________。
a.核磁共振氢谱有5个峰 b.能发生消去反应和氧化反应
c.能与钠反应放出氢气 d.能和NaOH溶液反应
(6)E有多种同分异构体,同时符合下列条件的同分异构体共有________种。其中不含甲基的有机物的结构简式为____________________。
①与NaHCO3溶液作用有气体放出 ②芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.除去氯化钠固体中的少量纯碱:加入过量氯化钙溶液,过滤、蒸发、结晶
B.除去CO2气体中的少量SO2:可将混合气体通过酸性高锰酸钾溶液
C.除去CO2中的少量的HCl:将气体通过盛有饱和Na2CO3溶液的洗气瓶
D.除去试管中残留的MnO2,加入稀盐酸并振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出2.24L(标准状况)气体时,H2SO4恰好完全消耗.求:
(1)反应中消耗的锌的质量是多少?(Zn:65)
(2)有多少个电子通过了导线?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com