
| A、标准状况下,2.24L苯中含有的C-H键的数目为0.6NA | B、标准状况下,由H2O2制得4.48L O2转移的电子数目为0.8NA | C、14g由乙烯与环丙烷组成的混合气体含有的碳原子数目为NA | D、常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA |


科目:高中化学 来源: 题型:
| A、与铜质水龙头连接处的钢质水管易发生腐蚀 |
| B、明矾常作为净水剂,双氧水通常可用于作杀菌消毒 |
| C、催化剂可以改变反应速率,对平衡移动没有影响 |
| D、合成氨工业中通过升高温度可以增大平衡常数K,来提高氨的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X射线 | B、天平 | C、红外光谱 | D、核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量是人们主观规定的基本物理量之一 | B、物质的量实质上就是物质的质量 | C、物质的量是人们根据其他的物理量推导出来的新的物理量 | D、物质的量是一种物理量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将28g Fe投人到1 Ll mol/L的硫酸中,可得到11.2LH2 | B、常温常压下,64g SO2气体含有的原子数目为3NA | C、25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | D、1mo1 Na被完全氧化生成Na2O2,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1的稀硫酸中含有的H+数为0.1NA | B、78g苯含有C═C双键的数目为3NA | C、常温下,20L pH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | D、标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L甲醇中含有的氧原子数为1.0NA | B、室温下,28.0g乙烯和丁烯的混合气体中含有的碳原子数目为2NA | C、标准状况下,2.24L CO2与足量的Na2O2充分反应,转移电子总数为0.2NA | D、25℃时,pH=1的1.0L H2SO4溶液中含有H+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L CH3OH含有C-H键数为1.5NA | B、1molO2和2molSO2在密闭容器中充分反应后的分子总数为2NA | C、在常温常压下,28g的一氧化碳和乙烯混合气体中所含分子总数大于NA | D、12g石墨和C60的混合物中质子总数为6NA |
查看答案和解析>>
科目:高中化学 来源:2014~2015学年重庆市9月月考高一化学试卷(解析版) 题型:填空题
(14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.①CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1= —574 kJ·mol- 1 .
②CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
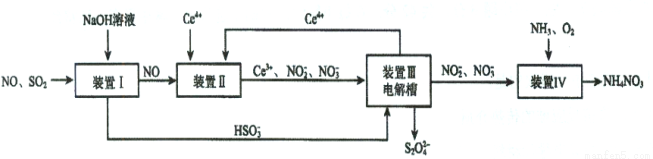
(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方
式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
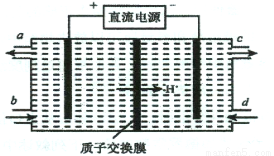
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com