
| A. | BaSO4的电离程度减小 | B. | BaSO4溶解的量减小 | ||
| C. | c(Ba2+)与c(SO42-)的乘积增大 | D. | 溶液的导电能力增强 |
分析 向其中加入少量硫酸钠固体,硫酸根离子浓度增大,平衡向着逆向移动,则硫酸钡的溶解度减小;硫酸钡为强电解质,在溶液中完全电离,则其电离程度不变;由于温度不变,则难溶物溶度积不变,故c(Ba2+)与c(SO42-)的乘积不变;溶液中离子浓度增大,溶液的导电性会增强,据此进行解答.
解答 解:A.硫酸钡在溶液中完全电离,则加入硫酸钠后,硫酸钡的电离程度不变,仍然为100%,故A错误;
B.加入硫酸钠后,溶液中硫酸根离子浓度增大,溶解平衡向着逆向移动,导致硫酸钡的溶解的量减小,故B正确;
C.c(Ba2+)与c(SO42-)的乘积为溶度积,由于温度不变,则硫酸钡的溶度积不变,故C错误;
D.加入硫酸钠后,溶液中离子浓度增大,则溶液的导电性增强,故D正确;
故选AC.
点评 本题考查了难溶物溶解平衡及其影响,题目难度中等,明确影响溶解平衡的因素为解答关键,注意溶度积只与难溶物性质、温度有关,为易错点,试题培养了学生的灵活应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 升高温度活化能降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
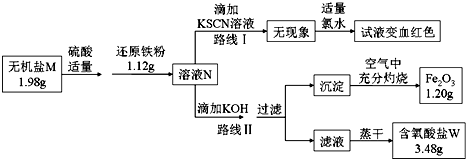
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌作阳极,铁制品作阴极,溶液中含有锌离子 | |
| B. | 锌作阴极,铁制品作阳极,溶液中含有锌离子 | |
| C. | 锌作阳极,铁制品作阴极,溶液中含有亚铁离子 | |
| D. | 锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
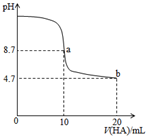 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液,pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点所示溶液中c(A-)>c(HA) | |
| D. | 滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
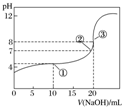
| A. | 该中和滴定过程,最宜用石蕊作指示剂 | |
| B. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| C. | 滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 | |
| D. | 图中点②所示溶液中,c(CH3COO-)=c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com