
【题目】下列各反应中不属于离子反应的是( )
A. 大理石和稀盐酸反应B. 盐酸和氢氧化钠溶液反应
C. 氢气在氧气中燃烧D. 铁和硫酸铜溶液反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的![]() ,较多的
,较多的![]() 和少量
和少量![]() 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜
为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜![]() 请根据下列流程图,完成回收硫酸亚铁和铜的实验方案
请根据下列流程图,完成回收硫酸亚铁和铜的实验方案![]() 可供选择的试剂为铁粉、稀
可供选择的试剂为铁粉、稀![]() 、NaOH溶液等试剂
、NaOH溶液等试剂![]()
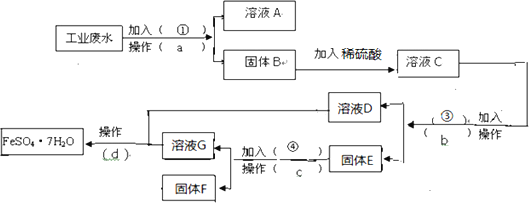
(1)操作a的名称为 ______ ,所需要的玻璃仪器为 ______ .
(2)固体E的成分为 ______ ,加入的试剂![]() 为 ______ ,发生的化学方程式为 ______ .
为 ______ ,发生的化学方程式为 ______ .
(3)加入试剂![]() 的目的是 ______ .
的目的是 ______ .
(4)从溶液D和溶液G中得到![]() 晶体的操作为 ______ 、冷却结晶、 ______ 、洗涤、干燥.
晶体的操作为 ______ 、冷却结晶、 ______ 、洗涤、干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确量取25.00 mL高锰酸钾溶液,可选用的仪器是( )
A.50 mL量筒
B.10 mL量筒
C.50 mL酸式滴定管
D.50 mL碱式滴定管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2 , MnO(OH)中锰元素的化合价为 .
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为(填化学式).[已知Ksp(MnS)=1.4×10﹣15 , Ksp(ZnS)=2.9×10﹣25 , Ksp(FeS)=6.0×10﹣18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1 , 其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2 . 写出反应 I的热化学方程式(焓变用△H1和△H2表示): .
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2 , 测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
t/min | 0 | 2 | 4 | 6 |
V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
0~2min时反应速率比2~4min时的快,其原因是 , 0~6min的平均反应速率v(H2O2)=(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
反应 | 平衡常数KP | |
773K | 873K | |
Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2(g) | 19.4 | 0.803 |
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
①反应I的正反应是(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为 . 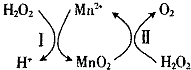
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答:
(1)H2O2的电子式 .
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)在AgCl沉淀中加入KBr溶液,白色沉淀转化为淡黄色沉淀,写出反应的离子方程式 .
(4)完成以下氧化还原反应的离子方程式: MnO4﹣+C2O42﹣+=Mn2+CO2↑+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化物的叙述正确的是( )
A. 金属氧化物都是碱性氧化物
B. 酸性氧化物均可与碱反应
C. 酸性氧化物都是非金属氧化物
D. 氧化铜是碱性氧化物,可与水反应生成Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列关于电解质溶液的说法正确的是( )
A.将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小
B.用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液)
C.向0.2 mol?L﹣1的盐酸溶液中加入等体积0.1 mol?L﹣1NH3?H2O溶液:c(Cl﹣)+c(OH﹣)═c(H+)+c(NH3?H2O)
D.在含0.1mol NaHSO4溶液中:c(H+)═c(SO ![]() )+c(OH﹣)
)+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有铁和铜的混合物17.5g,其中铁的质量分数为32%,与足量盐酸反应。
(1)参加反应的铁的物质的量是多少;__________
(2)生成标准状况下的氢气的体积__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com