
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题:
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数 (25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)____________。
③向NaCN溶液通入少量CO2反应的化学方程式是_________________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是__________________________________________________;此时c(HCN)/c(CN-)=________。
②HCN溶液有挥发性,HCN是有剧毒的物质,实验室在做有关NaCN的实验时尽量不采用的实验条件是__________________。
A、冰水浴 B、加热 C、浓溶液 D、稀溶液 E、酸性条件 F、碱性条件
③常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是__________________________________。
【答案】Na2CO3 b>a>c NaCN+CO2+H2O===NaHCO3+HCN CN-+H2O![]() HCN+OH- 2 BCE NaCN+H2O2+H2O===NaHCO3+NH3↑
HCN+OH- 2 BCE NaCN+H2O2+H2O===NaHCO3+NH3↑
【解析】
(1)根据相同条件下电离平衡常数越大对应酸的酸性越强,阴离子结合质子能力越弱进行分析;
(2)由酸性强弱结合题意书写化学方程式。
(1)①相同条件下,电离平衡常数越大,对应酸的酸性越强,根据表中数据可知酸性由强到弱的顺序为:HCOOH>H2CO3>HCN>HCO3-,所以HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是Na2CO3。
故答案为:Na2CO3。
②由于酸性c>a>b,所以体积相同、c(H+)相同的三种酸溶液分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是b>a>c。
故答案为:b>a>c。
③由于酸性H2CO3>HCN>HCO3-,所以向 NaCN溶液通入少量CO2反应的化学方程式是:NaCN+CO2+H2O = NaHCO3 +HCN,
故答案为:NaCN+CO2+H2O = NaHCO3 +HCN。
(2)①NaCN属于强碱弱酸盐,由于CN- +H2O ![]() HCN+OH-而使溶液呈碱性,pH=9。根据以上表中数据HCN的Ka=5.0×10-10,且Ka与水解平衡常数之积等于水的离子积常数,因此c(HCN)/c(CN-)=Kw/[Ka×c(OH-)]=10-14/[5×10-10×10-5]=2。
HCN+OH-而使溶液呈碱性,pH=9。根据以上表中数据HCN的Ka=5.0×10-10,且Ka与水解平衡常数之积等于水的离子积常数,因此c(HCN)/c(CN-)=Kw/[Ka×c(OH-)]=10-14/[5×10-10×10-5]=2。
故答案为:CN- +H2O ![]() HCN+OH-;2。
HCN+OH-;2。
②根据题意可知HCN溶液有挥发性,HCN是有剧毒的物质,NaCN浓度越大,其水解生成HCN的浓度越大,因此,实验室在做有关NaCN的实验时尽量不采用的实验条件是加热、浓溶液、酸性条件,故答案为:BCE。
③依据常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体(即为氨气),可知该反应的化学方程式是:NaCN+H2O2+H2O = NaHCO3 + NH3↑。
故答案为:NaCN+H2O2+H2O = NaHCO3 + NH3↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构如图,则下列说法正确的是( )
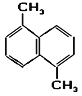
A. 该物质为苯的同系物
B. 该物质的官能团是苯环
C. 该物质能使酸性高锰酸钾褪色
D. 在铁做催化剂时,该物质可以和溴水发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A~J均为有机化合物,根据图中的信息,回答下列问题。
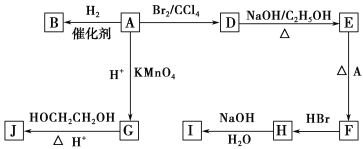
(1)环状化合物A的相对分子质量为82,其中含碳87.80%,含氢12.2%。B的一氯代物仅有一种,B的结构简式为_________________________。
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为__________________________________。
(3)由A生成D的反应类型是________,由D生成E的反应类型是________。
(4)G的分子式为C6H10O4,0.146 g G需用20 mL 0.100 mol·L-1 NaOH溶液完全中和, G 的结构简式为_________;
(5)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的烯烃与单烯烃可发生如下反应:
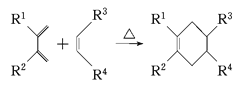
则由E和A反应生成F的化学方程式为______________________________________。
(6)H中含有的官能团是________,I中含有的官能团是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 糖类、油脂和蛋白质都是天然高分子化合物
B. 煤的干馏和石油的分馏都是化学变化
C. C4H9C1有4种同分异构体
D. 油脂都不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO及H2S都是有毒气体。下列有关这三种气体的说法正确的是 ( )
A. 都能与氧气反应 B. 都易溶于水
C. 都能与碱溶液反应 D. 都是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是 ( )
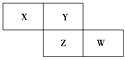
A. 原子半径:W>Z>XB. 非金属性:Z>Y
C. 最高化合价:X>ZD. 最高价氧化物对应水化物的酸性:W>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。请回答下列问题:
(1)Cu2O中阳离子的基态核外电子排布式为__________________; Cu和Ni在元素周期表中的位置相邻, Ni在周期表中的位置是__________________。
(2)将过量的氨水加到硫酸铜溶液中,溶液最终变成深蓝色,继续加入乙醇,析出深蓝色的晶体 [Cu( NH3)4]SO4·H2O。
①乙醇分子中C 原子的轨道杂化类型为__________________,NH3与H+以配位键形成NH4+,则NH4+的空间构型为____________________。
②[Cu( NH3)4]SO4·H2O]中存在的化学键除了极性共价键外,还有____________________。
③NH3极易溶于水的原因主要有两个,一是_______________,二是_______________________。
(3)CuSO4溶液中加入过量KCN溶液能生成配离子[Cu(CN)4]2-,1mol CN-中含有的π键数目为__________。与CN-互为等电子体的离子有____________(写出一种即可)。
(4)Cu 与F形成的化合物的晶胞结构如图所示,若晶体密度为a g·cm-3,则Cu与F最近距离为____________pm(用NA表示阿伏加德罗常数的值,列出计算表达式,不用化简)。
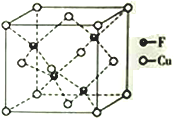
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有下列各组物质:
A.O2和O3 B.![]() 和
和![]()
C.![]() 和
和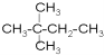
D.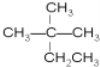 和
和 E.丁烷和新戊烷
E.丁烷和新戊烷
F.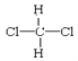 和
和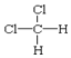 G.甲烷和庚烷
G.甲烷和庚烷
其中属于同分异构体的是____;属于同系物的是____;属于同种物质的是_____;属于同位素的是_______;属于同素异形体的是______。
Ⅱ.根据所学的有机化学反应类型,将下列反应进行归类,并按要求写出部分反应。
①由乙烯和HCl制氯乙烷 ②乙烷在空气中燃烧
③乙烯使溴水褪色 ④乙烯通入酸性高锰酸钾溶液
⑤乙烷与氯气光照 ⑥苯与硝酸在浓硫酸作用的条件下的反应
⑦苯与H2在镍作催化剂加热条件下的反应
⑧乙醇在铜作催化剂加热条件下与氧气的反应
(1)其中属于取代反应的有_____;属于氧化反应的有______;属于加成反应的有______。
(2)分别写出③⑥⑦的化学反应方程式:
③__________________
⑥__________________
⑦__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com