
【题目】反应2SO3(g)![]() 2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
2SO2(g) + O2(g)的能量与反应进程如图(a) 所示;在恒容密闭容器中充入SO3(g),T1°C测得其中的SO3(g)和O2(g)的浓度随时间变化如图(b) 所示。下列说法正确的是
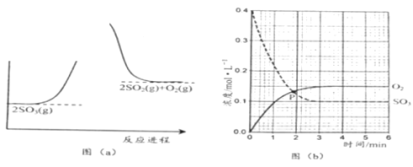
A.由图(a) 知,正反应为放热反应
B.图(b)中,SO3分解的平均速率0~1min比1~2min慢
C.图(b)中,P点时反应达到平衡状态
D.由图(b)知,SO2的平衡浓度为0.3mol·L-1
【答案】D
【解析】
A.由图(a) 知,反应物SO3(g)能量低,生成物2SO2(g) + O2(g)能量高,根据能量守恒定律,该反应的正反应为吸热反应,故A错误;
B.由图(b)知,浓度越大,反应速率越快,0~1min时SO3(g)减小了0.2mol/L,1~2min时SO3(g)减小了0.07mol/L,则0~1min平均速率比1~2min快,故B错误;
C.由图(b)知,P点时SO3(g)和O2(g)的浓度相等,隨着时间进行,SO3(g)继续减少,O2(g)继续增多,到3min时,二者浓度不再改变,达平衡状态,因而P点不是平衡状态,故C点错误;
D.由图(b)知,3min时达平衡状态,c(SO3)=0.10mol/L,消耗了0.3mol/L的SO3(g),根据2SO3(g)![]() 2SO2(g) + O2(g),可知达平衡时c(SO2)=0.3mol/L,故D正确;
2SO2(g) + O2(g),可知达平衡时c(SO2)=0.3mol/L,故D正确;
答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是()
选项 | 实验操作 | 现象 | 解释或结论 |
A | 把SO2通入紫色石蕊试液中 | 紫色先变红后褪色 | SO2具有漂白性 |
B | 向AgCl沉淀中清加KI溶液 | 白色沉淀变为黄色 | 溶度积:AgI比AgCl更小 |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变浅 | 反应2NO2 |
D | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,则下列说法中,正确的是( )
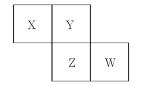
A.原子半径:W>Z>Y>X
B.形成氢化物的稳定性:Z>W
C.常温下:X、Y、Z、W形成的常见单质均为气态
D.W的单质能与水反应,生成一种具有漂白性的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废易拉罐(主要成分为Al,少量Fe等)制取明矾的实验流程如下:

(1)铝位于周期表第________周期________族。
(2)检验明矾中K+的方案是:用洁净的铂丝蘸取明矾少许,在酒精灯火焰上灼烧,_______,说明含有K+。
(3)配制100mL 3mol·L-1H2SO4溶液所需的玻璃仪器有:量筒、烧杯、玻璃棒、______和_____。
(4)写出“碱溶”时铝转化为偏铝酸钠的离子方程式: ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯的非金属性比氮的强,某同学依据反应3Cl2+2NH3=6HCl+N2进行实验证,设计的实验装置如下:
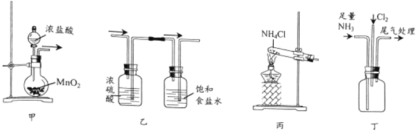
下列说法正确的是
A.可用图甲所示装置及药品制取Cl2B.可用图乙所示装置及气流方向净化Cl2
C.可用图丙所示装置及药品制取NH3D.可用图丁所示装置进行实验,瓶中有白烟产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积不变的密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
2NH3(g),下列叙述表示该反应处于化学平衡状态的是( )
A.N2、H2、NH3的浓度之比为1∶3∶2
B.混合气体的密度不随时间变化
C.当有1molN≡N键断裂时,有6molN—H键断裂
D.单位时间内生成2amolNH3,同时消耗amolN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn +8HNO2+ 3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为__________。
(2) CH3COOH中碳原子的杂化形式为________。
(3) NO3-的空间构型是①______,与NO3-互为等电子体的分子的化学式为②______(任写一种)。
(4) CH3COOH能与H2O以任意比互溶的原因是____________________。
(5)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为①_______,晶体中每个镁原子周围距离最近的铝原子数目为②_______,该晶体的密度为③______g/cm3(阿伏伽德罗常数的数值用NA表示)。
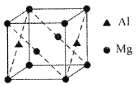
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.对金属制品进行抗腐蚀处理,可延长其使用寿命。
以下为铝材表面处理的一种方法:

碱洗的目的是除去铝材表面的自然氧化膜,碱洗时常有气泡冒出,其原因是__________(用离子方程式表示)。为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的_____。
A.NH3 B.CO2 C.NaOH D.HNO3
Ⅱ.某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现下图所示的物质之间的转化:

(1)试剂a最好选用________(选填A、B、C、D)。
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
(2)写出反应①的离子方程式:___________________________________。
(3)反应②的化学方程式为:____________________________________。
(4) 反应①结束后进行的操作是________________________
(5)固体E可以作为复合性的化学肥料,E中所含物质的化学式为________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com