
| A、含乙元素的化合物数目比含甲、丙元素的化合物数目多 |
| B、甲、丙元素最高价氧化物对应水化物的酸性强弱顺序为:甲<丙 |
| C、原子半径由大到小的顺序为丙>甲>乙 |
| D、乙元素的族序数比甲元素的族序数小 |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
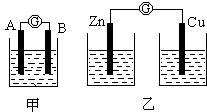 某同学设计实验探究构成原电池的条件,装置如下:
某同学设计实验探究构成原电池的条件,装置如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、21.2 g |
| B、21.6 g |
| C、22.0 g |
| D、22.3 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
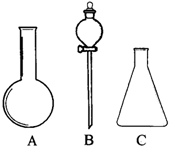 (1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
(1)有如图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com