
 已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.
已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.分析 (1)①醋酸是弱酸加水稀释醋酸电离程度增大,溶液中存在离子积常数,结合比值关系和电离平衡常数分析;
②25℃时,CH3COOH和NH3•H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3•H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,用pH试纸测定溶液pH的方法为:用玻璃棒蘸取少许待测液滴在PH试纸上,然后把试纸显示的颜色与标准比色卡对照,即可确定溶液的酸碱度,切记不能直接把试纸浸入待测液中,也不能先用水将pH试纸润湿后测定,因为这样做会稀释待测液,使测量结果不准;
③电离平衡常数Kb=$\frac{电离平衡状态下离子浓度乘积}{未电离的醋酸分子浓度}$;
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液发生反应生成醋酸铵溶液,铵根离子浓度增大,一水合氨浓度减小,当加入CH3COOH溶液体积为10mL时,酸碱恰好完全反应生成醋酸铵溶液,25℃时,CH3COOH和NH3•H2O的电离常数相等,溶液显中性;
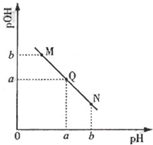
(3)①图象分析可知N点PH>POH,溶液显碱性,M点POH>PH,溶液显酸性,酸碱抑制水的电离,Q点POH=PH,溶液显中性;
②若Q点时滴加醋酸溶液体积为V2 mL,若恰好反应生成醋酸钠溶液显碱性,所以溶液呈中性醋酸应过量;
③若在曲线上某一点W时加入醋酸的体积为V1 mL,是醋酸和氢氧化钠溶液恰好反应生成醋酸钠,醋酸根离子水解溶液显碱性;
解答 解:(1)①25℃时,取10mL 0.1mol/L醋酸溶液测得其pH=3,溶液加水稀释至1000mL,氢离子浓度减小,PH大于3,醋酸电离被促进又电离出氢离子,氢离子浓度减小小于1000倍,则溶液PH小于5,溶液PH取值范围为:3<PH<5,溶液中离子浓度之比=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$=$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$,电离平衡常数和离子积常数随温度变化,所以加水稀释$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$比值不变,
故答案为:3<PH<5,不变;
②25℃时,CH3COOH和NH3•H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3•H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,溶液PH=11,pH试纸测定pH的方法是:将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值,
故答案为:11,将一小片pH试纸放在表面皿上,用玻璃棒或胶头滴管将待测液滴在试纸上,再将变色的试纸与标准比色卡对照读出数值;
③氨水(NH3•H2O溶液)溶液中电离平衡为:NH3•H2O?NH4++OH-,电离平衡常数表达式Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,25℃时,CH3COOH和NH3•H2O的电离常数相等,25℃时,0.1mol/L氨水(NH3•H2O溶液)电离出的氢氧根离子浓度为10-3mol/L,Kb=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1-1{0}^{-3}}$=1.0×10-5,
故答案为:$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,1.0×10-5;
(2)25℃时,现向10mL0.1mol/L氨水中滴加相同浓度的CH3COOH溶液发生反应生成醋酸铵溶液,铵根离子浓度增大,一水合氨浓度减小,$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小,当加入CH3COOH溶液体积为10mL时,酸碱恰好完全反应生成醋酸铵溶液,25℃时,CH3COOH和NH3•H2O的电离常数相等,醋酸根离子和铵根离子水解程度相同,溶液显中性,
故答案为:b,=;
(3)①图象分析可知N点PH>POH,溶液显碱性,M点POH>PH,溶液显酸性,酸碱抑制水的电离,Q点POH=PH,溶液显中性,水的电离程度最大,
故答案为:Q;
②若Q点时滴加醋酸溶液体积为V2 mL,若恰好反应生成醋酸钠溶液显碱性,所以溶液呈中性醋酸应过量,V1<V2,故答案为:<;
③若在曲线上某一点W时加入醋酸的体积为V1 mL,是醋酸和氢氧化钠溶液恰好反应生成醋酸钠,醋酸根离子水解溶液显碱性,PH>POH,所以溶液W点应位于图中曲线上Q点的下方,此时溶液中离子浓度由大到小的顺序为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故答案为:下方,c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
点评 本题考查了电解质溶液中离子浓度大小,弱电解质电离平衡影响因素,酸碱反应后溶液酸碱性的判断,主要是图象的理解应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 邻二甲苯属于芳香烃,它的官能团是 | |
| B. | 分子结构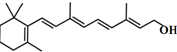 是维生素A的键线式 是维生素A的键线式 | |
| C. | 氯溴碘代甲烷的同分异构体数目有两个,就像人的左右手似的 | |
| D. | 乙醇与二甲醚互为同分异构体,这种同分异构现象叫官能团异构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 风能是人类通过风车等工具获取的能源,属于一次能源 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 在一个确定的化学反应中,反应物的总能量与生成物的总能量一定不同 | |
| D. | 原电池将把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
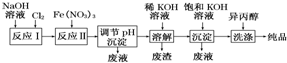
| A. | 反应Ⅰ主要为2NaOH+Cl2═NaCl+NaClO+H2O 反应Ⅱ的离子方程式为3ClO-+10OH-+2Fe3+═2FeO42-+3Cl-+5H2O | |
| B. | 加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 调节pH析出的沉淀为高铁酸钠,用异丙醇洗涤的主要目的是有利于产品干燥 | |
| D. | 高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,产生的Fe(OH)3有吸附性,有絮凝作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、Na+、NO3-、Cl- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Mg2+、Na+、Cl-、SO42- | D. | NH4+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PCl3和Cl2在一定条件下反应生成PCl5.
PCl3和Cl2在一定条件下反应生成PCl5.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH固体 | B. | Na2SO4固体 | C. | NH4Cl饱和溶液 | D. | CH3COONa固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com