
| A. | 不粘锅的内壁有聚四氟乙烯涂层,它不能使酸性高锰酸钾溶液褪色 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,两者互为同分异构体,且水解最终产物都是葡萄糖 |
分析 A.聚四氟乙烯中不含碳碳不饱和键;
B.煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料;
C.丙烷完全燃烧生成二氧化碳和水;
D.分子式相同、结构不同的有机物互称同分异构体.
解答 解:A.聚四氟乙烯中不含碳碳不饱和键,所以不能被酸性高锰酸钾溶液氧化,则不能使酸性高锰酸钾溶液褪色,故A正确;
B.因煤干馏可以得到煤焦油,煤焦油中含有甲烷、苯和氨等重要化工原料,可以通过分馏的方法进行分离,所以煤干馏可以得到甲烷、苯和氨等重要化工原料,故B正确;
C.丙烷完全燃烧生成二氧化碳和水,其产物不污染环境,所以是一种清洁燃料,故C正确;
D.分子式相同、结构不同的有机物互称同分异构体,如果n不同导致其分子式不同,所以不是同分异构体,但二者最终水解产物都是葡萄糖,故D错误;
故选D.
点评 本题考查有机物结构和性质、煤的干馏、同分异构体等知识点,明确物质结构和性质、基本概念等知识点是解本题关键,注意A中不含碳碳不饱和键,为易错点.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
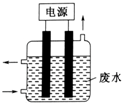
| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


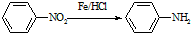 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
. 的同分异构体的结构简式
的同分异构体的结构简式 .(写出2种)
.(写出2种) ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
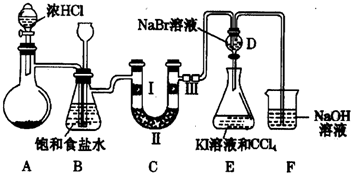
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com