
【题目】碱性硼化钒﹣﹣空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5 , 室温下用该电池为电源,用惰性电极电解饱和氛化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( ) 
A.外电路中电子由a电极流向b电极
B.电极上生成气体的体积为4.48L
C.乙装置中溶液的pH为13
D.VB2电极发生的电极反应为:VB2+11H2O﹣22e﹣=VB2+2B2O3+22H+
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】有关物质转化关系如下图,已知A是一种常见金属,F是一种红褐色沉淀。回答下列问题。

(1)A的化学式为_______;
(2)实验室保存C溶液时需加少量固体A,目的是_____________________。B与盐酸反应的离子方程式为_____________________________。
(3)检验C溶液中阳离子常用的方法是______________________________。
(4)E的浊液在空气中会变质生成F,对应现象为_______________________________ 。
(5)向C中加入Na2O2也可实现C向D和F的转化,Na2O2完全被还原。反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H 两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1∶2,肼的分子式为_____________。16g 肼分子中所含的氮原子数与标准状况下_______L N2中所含的氮原子数相等。
(2)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(3)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热方程式书写正确的是( )
A.2SO2+O2=2SO3△H=﹣196.6 kJ/mol
B.2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJ
O2(g)=H2O(l)△H=﹣285.8 kJ
D.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6一己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备.制备G的合成路线如图1:
回答下列问题:
(1)化合物A的质谱图如图2,则A的化学名称为 .
(2)C→D的反应类型为 .
(3)F的结构简式为 .
(4)由G合成尼龙的化学方程式为 .
(5)由A通过两步反应制备1,3﹣环己二烯的合成路线为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验过程中,我们往往需要记录一些实验的数据,下列数据可信的是:
A. 某常见气体的密度为2.8 g·cm-3
B. 用托盘天平称出固体的质量为7.85 g
C. 某正常雨水的pH为5.6
D. Ba(OH)2·8H2O晶体与NH4Cl晶体混合搅拌后,测得温度升高5℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应类型:①酯化、②取代、③消去、④加成、⑤水解、⑥还原,可能在有机物分子中引入羟基的是( )
A.①②③⑥
B.②④⑤⑥
C.②④⑥
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料.
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H= .
(2)已知25℃时,KSP(BaSO4)=1.1×1010 , 向仅含0.1molL﹣1 Ba(OH)2的废液中加入等体积0.12molL﹣1硫酸,充分搅拌后过滤,滤液中c(Ba2+)=
(3)上述冶炼过程中会产生大量的SO2 , 回收处理SO2 , 不仅能防止环境污染,而且能变害为宝,回收处理的方法之一是先将SO2转化为SO3 , 然后再转化为H2SO4 . ①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g)2SO3(g)△H<0,下列事实能表明该反应达到平衡的是 .
A.容器内气体密度不变
B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2
D.容器内压强不再发生变化
②450℃、0.1MPa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(α)随着时间(t)的变化如图1所示,则该温度下反应的平衡常数K= . 若维持其他条件不变,使反应开始时的温度升高到500℃,请在图1中画出反应开始到平衡时SO2转化率的变化图象.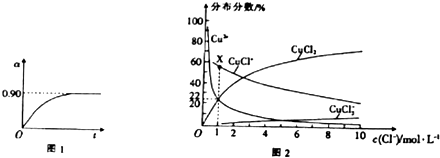
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl﹣)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中含铜微粒物质的量占铜元素总物质的量的百分比) ①若溶液中含铜微粒的总浓度为amolL﹣1 , 则X点对应的c(CuCl+)=(用含a的代数式表示).
②向c(Cl﹣)=1molL﹣1的氯化铜溶液中滴入少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com