
.某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色,反应进行4 s时NO2的浓度为0.04 mol·L-1,再经过一定时间后,反应达到平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是( )
A.前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.4 s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4 mol N2O4
D.平衡时容器内含0.8 mol NO2
B [ N2O4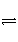
 2NO2
2NO2
n起始/mol 1 0
n变化/mol 0.2 0.04×10
n4 s/mol 0.8 0.4
前4 s N2O4的浓度变化为0.2 mol/10 L=0.02 mol·L-1;
因此前4 s N2O4的平均反应速率为0.005 mol·L-1·s-1,A不正确。
4 s时气体的总的物质的量为0.8 mol+0.4 mol=1.2 mol。
根据压强比等于物质的量比可得B正确。
设达到平衡时N2O4的物质的量变化了x。
N2O4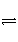
 2NO2
2NO2
n起始/mol 1 0
n变化/mol x 2x
n平衡/mol 1-x 2x
根据已知条件1 mol-x+2x=1 mol+x=1.8 mol,解得x=0.8 mol。
平衡时N2O4的物质的量为1 mol-x=1 mol-0.8 mol=0.2 mol,NO2的物质的量为2x=2×0.8 mol=1.6 mol,故C、D不正确。]


科目:高中化学 来源: 题型:
下列实验中,所加固体可以完全溶解的是
A.在H2O2溶液中加入少量MnO2粉末
B.将一小块铝片投入足量NaOH溶液中
C.将少量氢氧化铝加入足量的浓氨水中
D.常温下将一小块铁片投入足量的浓硝酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,下列叙述不是可逆反应A(g)+3B(g)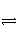
 2C(g)达到平衡状态标志的是( )
2C(g)达到平衡状态标志的是( )
①C生成的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的压强不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1∶3∶2
A.②⑧ B.①⑥ C.②④ D.③⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2
 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母)。
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是________(填字母)。
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
某些含羟基的药物具有苦味,如下所示结构的氯霉素: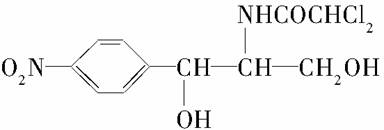 。此药物分子中碳链末端羟基(—OH)中的氢原子换成来自棕榈酸中的原子团
。此药物分子中碳链末端羟基(—OH)中的氢原子换成来自棕榈酸中的原子团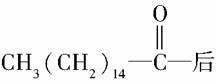 ,苦味消去,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是( )
,苦味消去,成为便于口服的无味氯霉素。以下关于无味氯霉素的叙述中正确的是( )
A.它是棕榈酸的盐类
B.它是棕榈酸的酯类
C.它的水溶性变差,所以苦味消失
D.它的水溶性变良,所以苦味消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com