
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
分析 A.蒸干时晶体分解失去结晶水;
B.pH试纸不能湿润;
C.酸碱中和放出大量的热;
D.溴不易溶于水,易溶于四氯化碳.
解答 解:A.蒸干时晶体分解失去结晶水,应冷却结晶制取CuSO4•5H2O,故A错误;
B.pH试纸不能湿润,用干燥的pH试纸来测溶液的pH,否则待测溶液稀释后浓度变小,故B错误;
C.酸碱中和放出大量的热,则不慎将浓碱溶液沾到皮肤上,可先立即用大量水冲洗,再涂上2%~5%的硼酸溶液,故C错误;
D.溴不易溶于水,易溶于四氯化碳,则用四氯化碳萃取溴水中的溴,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、pH测定、实验安全、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析和实验安全,题目难度不大.


科目:高中化学 来源: 题型:实验题
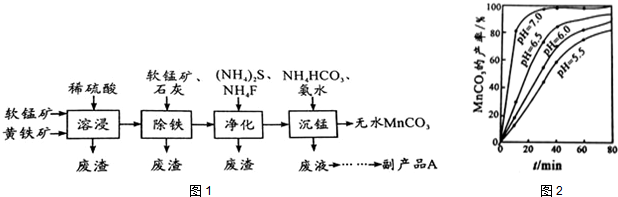
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
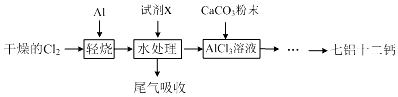
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2和O2的反应 | B. | Na和O2的反应 | C. | Fe和Cl2的反应 | D. | 铜和硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | QGZYX | B. | GYQZX | C. | GYZQX | D. | ZXGYQ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外观澄清 | B. | 丁达尔效应 | ||
| C. | 胶体在一定条件下能稳定存在 | D. | 分散质粒子直径在1nm~100nm之间 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
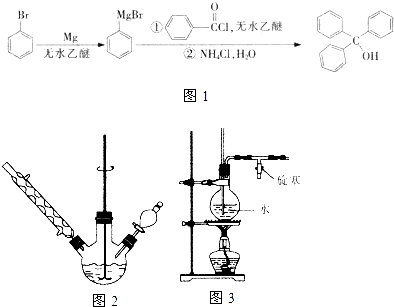 三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:
三苯甲醇是一种重要有机合成中间体,可以通过下列原理进行合成:实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com