
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、NaHCO3溶液和Na2CO3溶液中含有的粒子种类完全相同 |
| B、用一定浓度的NaOH溶液滴定氢氟酸,当pH=6时,溶液中c(F-)-c(Na+)=9.9×10-7mol/L |
| C、中和同浓度同体积的盐酸和醋酸,消耗的NaOH的物质的量不相同 |
| D、用0.2 mol/L NaOH溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在0.1mol?L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热后红色加深,说明盐类水解反应是吸热反应 |
| B、用铂丝蘸取少量某溶液进行焰色反应,透过蓝色钴玻璃观察到火焰呈紫色,该溶液一定是钾盐溶液 |
| C、向某FeCl2溶液中加入KSCN溶液,观察到溶液呈血红色,说明该溶液中FeCl2已全部被氧化 |
| D、向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、护发素的主要功能是调节头发的pH,使之达到适宜的酸碱度 |
| B、厕所清洁剂、醋、肥皂、厨房清洁剂的pH依次增大 |
| C、仅用1mol/L KI溶液、0.1mol/L H2SO4溶液和淀粉溶液(仪器不限),就可以探究温度对化学反应速率的影响 |
| D、将少量Mg(OH)2沉淀和适量氯化铵溶液混合,无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度相同时HA溶液的导电性比强酸弱 |
| B、10mL 1mol/L的HA溶液与10mL 1mol/L的NaOH溶液恰好完全反应 |
| C、NaA溶液的pH>7 |
| D、0.1mol/LHA溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 醋酸是中学常用的一种弱酸.
醋酸是中学常用的一种弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
图示 |
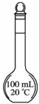 |
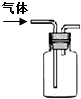 |
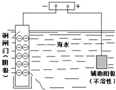 |
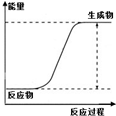 |
| 说明 | 该仪器用于配制一定质量分数的溶液 | 该装置可以收集二氧化氮 | 该装置可保护钢闸门不被腐蚀 | 该化学反应为吸热反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com