
| A. | 10 mL 0.1 mol/L AlCl3溶液 | B. | 20 mL 0.1 mol/L CaCl2溶液 | ||
| C. | 30 mL 0.2 mol/L KCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
分析 根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关,结合选项判断即可.
解答 解:A、10mL0.1 mol/L AlCl3溶液中c(Cl-)=3c(AlCl3)=0.1mol/L×3=0.3mol/L;
B、20mL0.1mol/L CaCl2溶液中c(Cl-)=2c(CaCl2)=0.1mol/L×2=0.2mol/L;
C、30mL0.2mol/L KCl溶液中c(Cl-)=c(KCl)=0.2mol/L×1=0.2mol/L;
D、KClO3溶液中无氯离子,故D错误.
所以氯离子浓度最大的是0.3mol/L.
故选A.
点评 本题考查了物质的量浓度的有关计算,根据溶液中c(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可,易错选项是D,注意氯酸钾中含有氯酸根离子不含氯离子.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
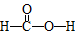 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: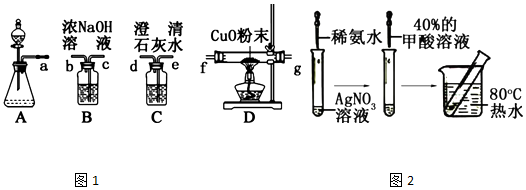
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 根据要求回答下列问题:
根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此沉淀是Mg(OH)2、Ca(OH)2的混合物 | |
| B. | 此沉淀只有Mg(OH)2 | |
| C. | 过滤后滤液中存在Ca2+、Mg2+ | |
| D. | 向原溶液中加入8.8 g NaOH固体,不可以使Ca2+部分转化为沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
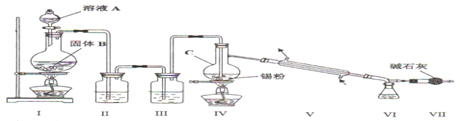
 用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:
用1-丁醇、溴化钠和较浓H2SO4混合物为原料,在实验室制备1-溴丁烷,并检验反应的部分副产物.(已知:NaCl+H2SO4(浓)=NaHSO4+HCl↑)现设计如下装置,其中夹持仪器、加热仪器及冷却水管没有画出.请回答下列问题:| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com