
| A、pH=7的醋酸钠和醋酸的混合溶液中,c(Na+)=c(CH3COO-) |
| B、O.1mol?L-1的醋酸的pH=a,0.01mol?L-1的醋酸的pH=b,则a+1>b>a |
| C、20mL0.1mol?L-1醋酸钠溶液与10mL0.1mol?L-1盐酸混合后溶液显酸性,则c(H+)+c(Na+)=c(CH3COO-)+c(Cl-) |
| D、已知酸性:HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中,[c(Na+)-c(F-)]<[c(K+)-c(CH3COO-)] |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
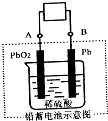 CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是
CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是2- 4 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlO2- |
| B、Al3+ |
| C、Mg2+ |
| D、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属单质与盐溶液的反应都是置换反应 |
| B、SO2和CO2都是酸性氧化物,都能与NaOH溶液反应 |
| C、Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| D、C、N、S三种单质直接与O2反应都能生成两种以上氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
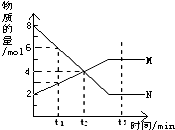 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2N?M |
| B、Bt2时,正逆反应速率相等,达到平衡 |
| C、t1时,N的浓度是M的浓度的2倍 |
| D、t3时,正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH═11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、同浓度同体积的强酸与强碱溶液混合后,溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl的溶解度增大 |
| B、AgCl的溶解度、Ksp均不变 |
| C、Ksp(AgCl)增大 |
| D、AgCl的溶解度、Ksp均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、降低温度 |
| B、增大压强 |
| C、升高温度同时充入N2 |
| D、用时将CO2和N2从反应体系中移走 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com