
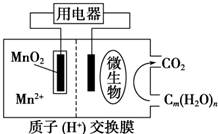
| A. | 正极反应式为MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在电极区放电时发生还原反应 | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6g |
分析 形成原电池时,微生物所在电极区发生氧化反应,Cm(H2O)n被氧化生成水和二氧化碳,MnO2被还原生成Mn2+,为原电池的正极,放电时,阳离子向正极移动,阴离子向负极移动,以此解答.
解答 解:A.MnO2被还原生成Mn2+,为原电池的正极,电极方程式为MnO2+4H++2e-═Mn2++2H2O,故A正确;
B.,微生物所在电极区发生氧化反应,Cm(H2O)n被氧化生成水和二氧化碳,故B错误;
C.原电池工作时,阳离子向正极移动,故C错误;
D.给铅蓄电池充电,阴极发生PbSO4 +2e-=Pb+SO42-,电极质量减小,故D错误.
故选A.
点评 本题考查新型电池,为高频考点,题目难度不大,注意把握原电池的工作原理以及电极反应式的书写,解答本题的关键是根据物质的性质判断原电池的正负极.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:解答题
 请根据所学化学反应原理,解决以下问题:
请根据所学化学反应原理,解决以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol-OH(羟基)与l mol NH4+中所含电子数均为10NA | |
| B. | 25℃时,100 mL pH=l的稀硫酸中,含有的H+数目为0.01 NA | |
| C. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1 NA | |
| D. | 标准状况下,2.24LNO2和N2O4混合气体中含0.2 NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为2NA | |
| B. | 1LpH=2的NaHSO3溶液中,由水电离的H+数目为0.01 NA 个 | |
| C. | 1.5gCH3+里含有的电子数目为NA | |
| D. | 62g白磷中含有P_P键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br2+2e-═2Br- | B. | 2Br--2e-═Br2 | C. | Zn-2e-═Zn2+ | D. | Zn2++2e-═Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com