
| A. | ①② | B. | ③④ | C. | ①②③ | D. | ①③④ |
分析 ①S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化;
②碳碳双键中一个是σ键,还有一个是π键;
③首先判断价层电子对数目和有无孤电子对,进而判断分子的空间构型;
④先确定VSEPR模型,然后在确定中心原子的杂化轨道类型;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答 解:①S8是一个环形分子,每个S与两个其它S原子相连,S原子外层6个电子,两对孤对电子,两上σ键,所以S是sp3杂化,故正确;
②碳碳双键中一个是σ键,还有一个是π键,所以不只是碳氢σ键,故错误;
③SnBr2分子中,Sn原子的价层电子对数目是$\frac{4+2}{2}$=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°,故正确;
④H3O+价层电子对模型为四面体,氧原子采取sp3杂化,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,故正确;
故选D.
点评 本题考查了分子或离子中原子轨道杂化类型的判断,根据价层电子对互斥理论来分析解答是关键,注意SnBr2分子中心原子的杂化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | HClO的电子式: | |
| B. | 中子数为20的氯原子:1720Cl | |
| C. | CCl4的电子式: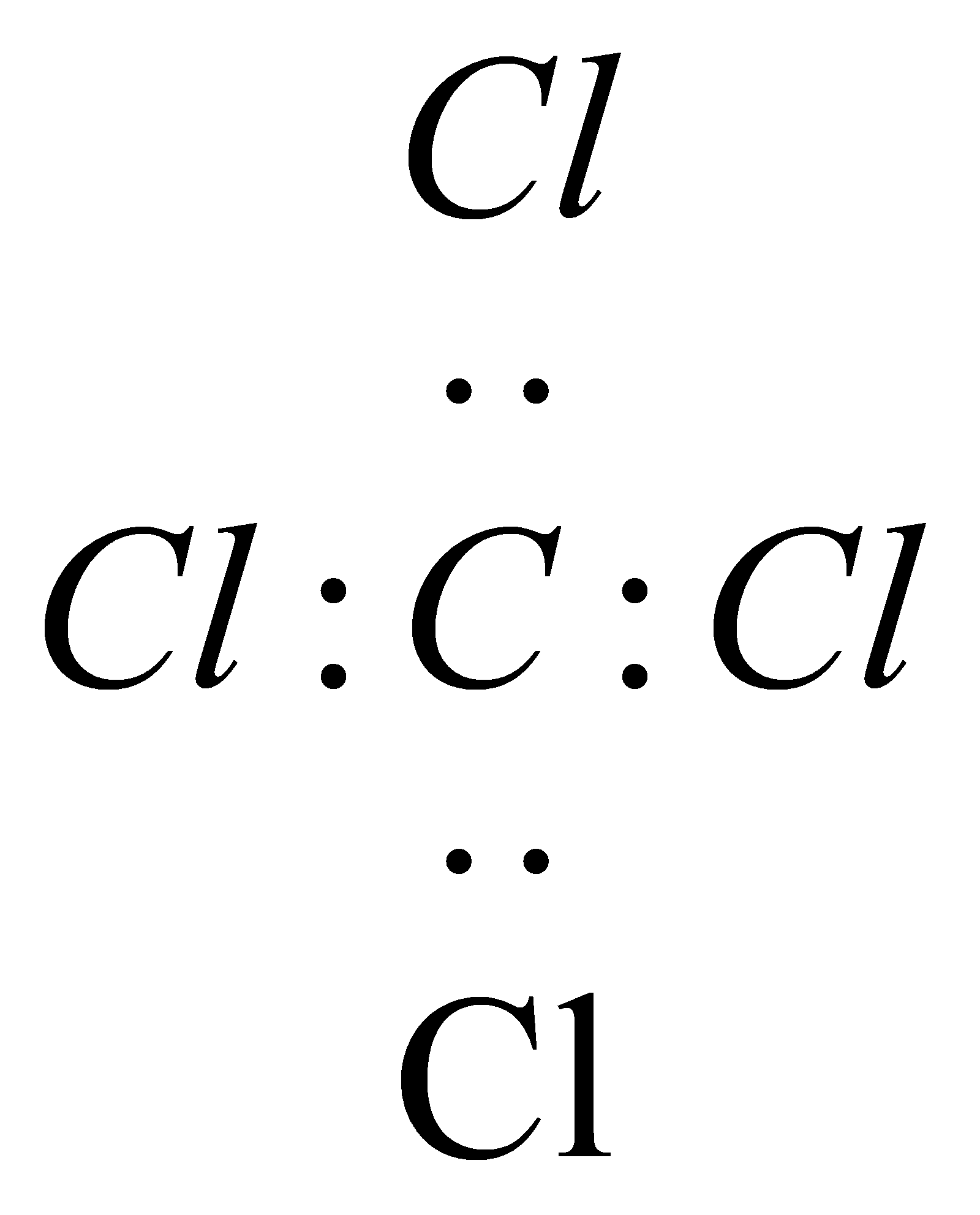 | |
| D. | Cl-的结构示意图: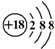 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅的单质都可用作半导体材料 | B. | 石英可用来制造光导纤维 | ||
| C. | 碳化硅可用作砂纸、砂轮的磨料 | D. | 水玻璃可作黏合剂及耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
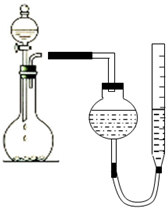 某学生用图所示的装置测定镁的相对原子质量:
某学生用图所示的装置测定镁的相对原子质量:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有离子键的化合物才是离子化合物 | |
| B. | 硫酸铵晶体是含有离子键、极性键和配位键的分子晶体 | |
| C. | 由于I-I键的键能比F-F、Cl-Cl、Br-Br键的键能都小,所以在卤素单质中碘的熔点最低 | |
| D. | 在分子晶体中一定不存在离子键,而在离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤与结论: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的消耗速率等于NO的生成速率 | |
| B. | NH3的消耗速率等于NO的消耗速率 | |
| C. | NH3的浓度和NO的浓度都不发生改变 | |
| D. | 密闭容器内的压强不发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 晶体硅可用于制造光导纤维 | D. | 铝制容器可长期存放酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中一定存在分子间作用力 | |
| B. | 分子中含有两个氢原子的酸一定是二元酸 | |
| C. | 含有金属阳离子的晶体一定是离子晶体 | |
| D. | 元素的金属性越强,失去的电子数就越多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com