

 .
.分析 氯碱厂电解饱和食盐水生成氯气和氢氧化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,可用结晶的方法除去氯化钠;铁和稀硫酸反应生成硫酸亚铁,加入过氧化氢,生成硫酸铁,次氯酸钠和硫酸铁发生氧化还原反应生成Na2FeO4,以此解答该题,
(1)依据氢氧化钠的化学键的形成过程和电子式书写方法写出电子式;
(2)Fe2+被加过氧化氢氧化为Fe3+,加入检验Fe3+的试剂即可;
(3)依据流程分析判断,步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,依据电子守恒、电荷守恒和原子守恒反应的离子方程式;
(4)碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式依据氧化还原反应电子守恒和原子守恒配平得到;
(5)依据高铁酸根离子发生的还原反应分析判断;
(6)依据高铁酸钠和氯气得到电子转化关系计算分析,根据高铁酸钠是强氧化剂,得到电子生成氢氧化铁胶体分析判断.
解答 解:(1)氢氧化钠是两种化合物,由钠离子和氢氧根离子构成,氢氧根中氧原子和氢原子形成共价键,电子式为: ,
,
故答案为:
(2)Fe2+被加过氧化氢氧化为Fe3+的反应为:2Fe2++H2O2+2H+=2Fe3++2H2O.取样滴入KSCN溶液变红,证明有Fe3+的生成,步骤②反应发生了,
故答案为:KSCN;
(3)步骤②是加入过氧化氢在酸性溶液中氧化亚铁离子为铁离子的过程,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)反应③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(5)依据高铁酸钠在碱性溶液中稳定存在,发生的反应为:FeO42-+3e-+4H2O?Fe(OH)3+5OH-,污水的PH越高平衡逆向进行,PH越小平衡正向进行,依据图象分析Ⅱ先达到平衡需要的时间短,反应速率快,说明污水PH小,曲线I比曲线II对应的污水的PH高;
故答案为:高;
(6)FeO42-+3e-+4H2O?Fe(OH)3+5OH-,单位质量得到电子$\frac{3}{166}$=0.018
Cl2+2e-=2Cl-,单位质量得到电子$\frac{2}{71}$=0.028,所以Na2FeO4的消毒效率比氯气低,高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用;
故答案为:低;既能消毒杀菌又能净水(或无毒或方便保存等).
点评 本题考查了物质制备实验流程的分析判断,主要是物质性质,题干信息的应用,离子方程式的书写是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
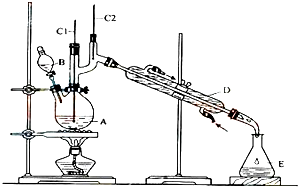 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量W,逆反应速率增大 | |
| B. | 因正反应吸热,所以升高温度正反应速率加快,逆反应速率减慢 | |
| C. | 当v(X)=v(Z)时,反应达到平衡 | |
| D. | 混合气体的密度不变时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少 | B. | 增大 | ||
| C. | 不变 | D. | 无法判断变化情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
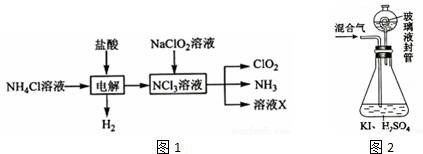
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
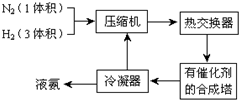
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
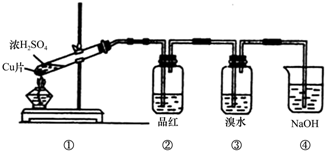
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com