
| A. | 核反应发电实现了化学能到电能的转化 | |
| B. | 115 号元素一定是处于VA 族的非金属元素 | |
| C. | 117 号元素与F、Cl、Br、I 均处于VIIA 族 | |
| D. | 四种新元素位于元素周期表中的不同周期 |
科目:高中化学 来源: 题型:选择题
| X | ||||
| Z | W |
| A. | X和氢组成的化合物分子中可能含有极性共价键和非极性共价键 | |
| B. | 工业上用电解Y和W组成的化合物来制备Y | |
| C. | Z、W两元素的气态氢化物中,W的气态氢化物更稳定 | |
| D. | X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外界条件可以改变平衡状态 | B. | 达到平衡时正、逆反应速率相等 | ||
| C. | 平衡时各组分的含量也在不断变化 | D. | 该反应所建立的平衡是动态平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
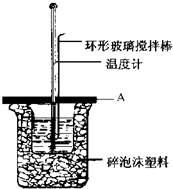 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1NaOH溶液利用上图装置,进行测定中和热的实验.假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g•℃).为了计算中和热,实验时还需测量的数据有(填序号)ACE.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
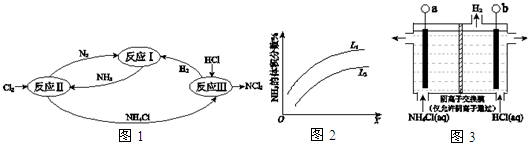
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子而HClO为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X单质在M单质中燃烧产生苍白色火焰,M最高价态含氧酸是已知的最强酸 | |
| B. | Z与W可生成W2Z和W2Z2,且W2Z2溶于水时,既有离子键、极性键、非极性键的断裂,又有离子键、极性键、非极性键生成 | |
| C. | X、Y、Z三种元素形成的化合物可能含离子键、共价键 | |
| D. | X与Z可形成10电子和18电子的化合物,分子中只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com