
【题目】室温下,用0.10mol/L的氢氧化钠溶液滴定10.00mL0.10mol/L醋酸溶液,水的电离度随氢氧化钠溶液体积的变化曲线如图所示,下列说法正确的是( )

A.该滴定过程应该选择甲基橙作为指示剂
B.N点溶液中c(OH-)=c(CH3COO-)+c(CH3COOH)+c(H+)
C.从P点到N点,溶液中水的电离程度逐渐增大
D.M点对应的NaOH溶液的体积为10.00mL
【答案】D
【解析】
A. CH3COOH与NaOH恰好反应时生成强碱弱酸盐醋酸钠,溶液呈碱性,而甲基橙的变色范围为3.1-4.4,应该选用酚酞作为滴定指示剂,故A错误;
B. N点溶液中溶质为等浓度的NaOH和醋酸钠,根据电荷守恒可得:c(H+)+c(Na+)=c( CH3COO)+c(OH),有物料守恒可得:c(Na+)=2c(CH3COO)+2 c(CH3COOH),把钠离子消去可得:c(OH-)=c(CH3COO-)+2c(CH3COOH)+c(H+),故B错误;
C. 根据图象曲线变化可知,溶液中水的电离程度逐渐增大,恰好反应时达到最大,之后又开始减小,故C错误;
D. M点水的电离程度最大,说明此时溶质为醋酸钠,醋酸与氢氧化钠恰好反应,则对应的NaOH溶液的体积为10.00mL,故D正确;
故选:D。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O―→
H2O―→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O![]() Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________。
(2)上述反应①中氧化剂为______,被氧化的物质是______。若有2 mol Na2FeO2生成,则反应①中有________mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________(填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,推出图中标记的11种元素,回答下列问题:

(1)⑤的简单阴离子的结构示意图为_______,的原子序数为___________。
(2)④的简单氢化物的电子式为__________________。
(3)在11种元素中,单质的化学性质最不活泼的是__________(填化学式)。
(4)⑧、⑨两种元素形成的最高价氧化物的水化物中,酸性较强的是_______(填化学式)。
(5)加热时,③的单质能和⑧的最高价氧化物的水化物的浓溶液发生反应,化学方程式为___________。
(6)⑦在元素周期表中的位置是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求,回答下列问题
I.氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应均为2H2+O2 = 2H2O。
(1)工作时,电解质溶液中的阴离子移向_______极(填“正”或“负”)。
(2)酸式氢氧燃料电池的电解质溶液是稀硫酸,其正极的电极反应为________。
(3)碱式氢氧燃料电池的电解质溶液是KOH溶液,其负极的电极反应为_______。
II.通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示,O2-可在固体电解质中自由移动。
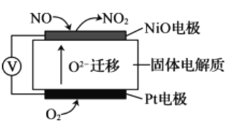
(1)NiO电极上发生的是________反应(填“氧化”或“还原”)。
(2)外电路中,电子是从_________电极流出(填“NiO”或“Pt”)。
(3)Pt电极的电极反应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成的中间体,G的一种合成路线如下:
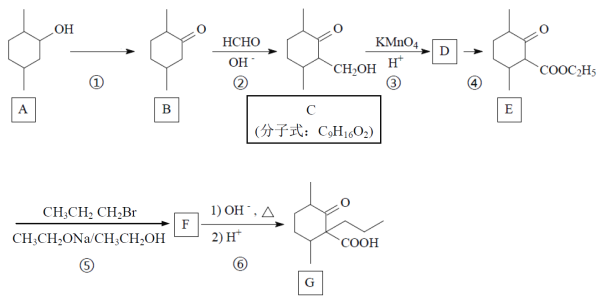
(1)写出A中官能团的电子式。_____________。
(2)写出反应类型:B→C___________反应,C→D__________反应。
(3) A→B所需反应试剂和反应条件为_______________________________。
(4) 写出C的符合下列条件同分异构体的结构简式:_________________________。(任写出3种)
①能水解;②能发生银镜反应;③六元环结构,且环上只有一个碳原子连有取代基。
(5)写出F的结构简式_______________________。
(6)利用学过的知识,写出由甲苯(![]() )和
)和![]() 为原料制备
为原料制备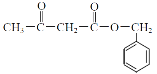 的合成路线。(无机试剂任用)_____________________。
的合成路线。(无机试剂任用)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)
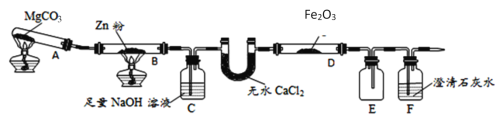
(1)图中盛无水CaCl2的仪器名称为______装置B中的化学反应方程式为_______。
(2)装置C中发生反应的离子方程式为_________,处理尾气的方法为________。
(3)将研究小组分为两组,按上图装置进行对比实验,探究不同温度条件下黑色固体的成分,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物)。两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末成分是________。
②根据甲组实验现象写出甲组步骤1中反应的离子方式__________。
③乙组步骤4中,溶液变红的原因为________,溶液褪色可能的原因________及其验证方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O =Al(OH)3↓+3H+
C.Na2O2溶于水产生O2:Na2O2+H2O =2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。

参数 分子 | 分子直径/nm | 分子与H2O的结合能E/kJ·mol-1 |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中分子间存在的两种作用力是_____________________________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是_____。
(2) H2O与CH3CH2OH可以任意比例互溶,除因为它们都是极性分子外,还因为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com