
下列说法正确的是
A.还原性染料靛蓝的结构简式为: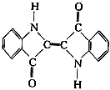 ,它的分子式是:C16H10N2O2
,它的分子式是:C16H10N2O2
B.结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙烯
C.总质量一定时,乙炔和乙醛无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变
D.丙烯酸(CH2=CHCOOH)和山梨酸(CH3CH=CHCH=CHCOOH)不是同系物,它们与氢气充分反应后的产物也不是同系物
科目:高中化学 来源:2014-2015江西省高一上学期期末化学试卷(解析版) 题型:选择题
下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入HNO3 ,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀 |
B | CO2通入BaCl2溶液中 | 有白色沉淀出现 | 生成了BaCO3沉淀 |
C | Al箔插入稀 | 无现象 | Al箔表面被 |
D | 用玻璃棒蘸取浓硝酸点到蓝色石蕊试纸上 | 试纸先变红色后褪色 | 浓硝酸有酸性和氧化性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学键与晶体说法中,不正确的是
A.离子晶体的晶格能越大,离子晶体的密度就越大
B.共价键的键能越大,分子晶体的熔、沸点越高
C.成键原子的原子轨道重叠越多,共价键越牢固
D.共用电子对不发生偏移的化学键是非极性共价键
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三3月阶段测试理综化学试卷(解析版) 题型:选择题
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
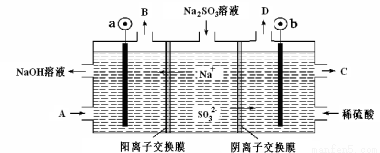
A.b电极上的主反应是 SO32--2e-+H2O===SO42-+2H+
B.若D是混合气体,则可能含有SO2、O2等成分
C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省温州市高三一模理综化学试卷(解析版) 题型:推断题
(18分)Ⅰ.A、B、C、D、E、F是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
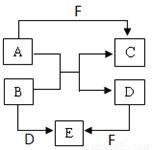
(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去)
则B+D→E的离子方程式为 ,C为同周期元素构成的1∶1型化合物,则C的电子式为 。
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为 ,A+B→C+D的化学方程式为 。
Ⅱ.甲、乙都是二元固体化合物,将32g甲的粉末加入足量浓硝酸并加热,完全溶解得蓝色溶液,向该溶液中加入足量Ba(NO3)2溶液,过滤、洗涤、干燥得沉淀46.6g;滤液中再滴加NaOH溶液,又出现蓝色沉淀。
含乙的矿石自然界中储量较多,称取一定量乙,加入稀盐酸使其全部溶解,溶液分为A、B两等份,向A中加入足量氢氧化钠溶液,过滤、洗涤、灼烧得红棕色固体28g,经分析乙与红棕色固体的组成元素相同,向B中加入8.0g铜粉充分反应后过滤、洗涤、干燥得剩余固体1.6g.
(1)写出构成甲的阴离子的结构示意图 ;32g甲在足量浓硝酸中反应转移的电子数为 ;甲在足量氧气中充分灼烧的化学方程式为 。
(2)乙的化学式 ;稀硫酸溶解乙的化学方程式为 。
(3)将甲在足量氧气中充分灼烧的气体产物通入一定量A溶液中,该反应的离子方程式为 ,设计实验证明此步反应后的溶液中金属元素的化合价 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:填空题
铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体。
(1)基态Au原子有 个未成对电子,Cu2+的电子排布式为 ,向Cu2+溶液中加入足量的氨水后,再加入无水乙醇,可析出一种配合物,其中N原子的杂化轨道类型为______________,该配合物的颜色为 。
(2)Cu2O是一种共价型化合物,其立方晶胞内:氧原子分别位于立方体的顶点和体心,则该晶胞中有个铜原子,其中氧原子的配位数为 。
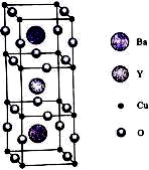
(3)钇钡铜氧超导体的理想晶胞如图所示,其化学式为: ,该晶体中Y为+3,Ba为+2,铜为+2、+3,则铜元素中+2价铜的百分含量为 ;Y的价电子排布式为4d15s2,则Y在周期表的位置: ,
(4)已知Ag的晶胞参数a=0.408 nm,列式表示Ag单质的密度_________g·cm-3(不必计算出结果)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省大冶市高三上学期期末联考理综化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,常温下,抽去下图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是

A.反应前气体的总体积为1.344L
B.装置中产生大量的白色烟雾
C.反应前后分子总数不变,均为0.06 NA个
D.生成物充分溶于水后所得溶液含有0.01 NA个NH4+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省兰州市高三下学期诊断考试理综化学试卷(解析版) 题型:推断题
[化学―选修5:有机化学基础](15分)塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示:
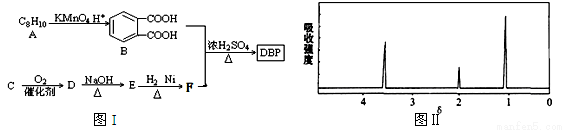
已知以下信息:
①
②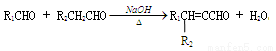 (—R1、R2表示氢原子或烃基)
(—R1、R2表示氢原子或烃基)
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图II所示
(1)C的结构简式为 ,E中所含官能团的名称是 。
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F: ;
②B和F以物质的量比1︰2合成DBP: ;反应类型为 。
(3)同时符合下列条件的B的同分异构体有 种,写出其中任意两种同分异构体的结构简式 。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeC13溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市高三教学质量检查理综化学试卷 (解析版) 题型:填空题
(14分)甲、乙、丙是常见的三种物质,它们之间有如图所示的转化关系。根据要求回答问题:
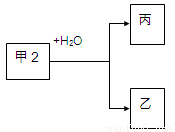
I、已知:甲是常见单质,丙为氢气。
(1)若乙为氧化物且有磁性,则乙发生铝热反应的化学方程式为 。
(2)若甲为碳,则产物乙、丙可合成甲醇。
①已知:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CH4(g)+H2O(g) CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
CH3OH(g)+H2(g) ΔH=+77.0 kJ·mol-1
写出气体乙与气体丙反应生成CH3OH(g)的热化学方程式:__________________。
②乙和丙合成甲醇的反应在不同温度下的化学平衡常数(K)如下表。则T1 ______ T2(填“>”、“<”、“=”)。
温度/℃ | T1 | T2 |
K | 2.041 | 0.012 |
③乙可做某碱性燃料电池的燃料,该电池的负极反应式为_________________。
II、已知:甲是由两种短周期元素组成的化合物,丙的水溶液显碱性。
(3)若构成甲的阴、阳离子个数比为2:3,丙是气体。则构成甲的阴、阳离子半径大小关系为 (用具体的微粒表示)。
(4)若乙是O2,则甲的一种重要用途是 ;产物丙与Cl2按2:1(物质的量)反应得到丁溶液,丁溶液中阴离子浓度从大到小的顺序是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com