
【题目】锂是高能电池的理想负极,常用乙腈、二甲基甲酰胺等有机溶剂和LiC1O4、LlBF4、LiBr等电解质制成锂非水电池。回答下列问题:
(1)二甲基甲酰胺(![]() )中基态氮原子的电子排布是__,乙腈( CH3- C≡N)中碳原子的杂化轨道类型为___。
)中基态氮原子的电子排布是__,乙腈( CH3- C≡N)中碳原子的杂化轨道类型为___。
(2)LiClO4和LlBF4中都不存在的化学键是____(填代号)。
a.离子键 b.共价键 c.金属键 d.配位键
(3)LiX(X=F,Cl,Br,I)具有NaCl型晶体结构。当阴、阳离子电荷的绝对值相同且它们的半径相近时,生成的盐类一般难溶于水。由上述规则可以判断LiF、LiCl、LiBr、LiI中溶解度最小的是_______ 。
(4)Li2S属立方晶体,晶胞边长为dpm,晶胞截面图如下所示。每个晶胞中含有S2-的数目为_____,S2-的配位数是_______,NA表示阿伏加德罗常数的值,则Li2S晶体的密度为_______gcm-3(用代数式表示)。

【答案】1s2 2s22p3 sp3杂化、 sp 杂化 c LiF 4 8 ![]() × 1030
× 1030
【解析】
(1)N元素为7号元素,所以基态N原子的电子排布式为1s22s22p3;乙腈( CH3- C≡N)中甲基上的碳原子形成4个σ键,所以为sp3杂化,另一个碳原子形成碳氮三键,所以为sp杂化;
(2)LiClO4中存在锂离子和高氯酸根之间的离子键、氧原子和氯原子之间的共价键;LlBF4中存在Li+和BF![]() 之间的离子键、B原子和F原子之间的共价键,B原子最外层电子数为3,而与4个F原子成键,说明其中有一个为配位键;金属晶体中才存在金属键;综上所述,LiClO4和LlBF4中都不存在的化学键是金属键,所以选c;
之间的离子键、B原子和F原子之间的共价键,B原子最外层电子数为3,而与4个F原子成键,说明其中有一个为配位键;金属晶体中才存在金属键;综上所述,LiClO4和LlBF4中都不存在的化学键是金属键,所以选c;
(3)Li+带一个单位正电荷,有1层电子;Xˉ均带一个单位负电荷,而Fˉ、Clˉ、Brˉ、Iˉ的半径依次增大,其中与Li+半径最接近的为Fˉ,根据题意可知LiF的溶解度最小;
(4)根据晶胞截面图可知,白球即S2-位于顶点和面心,黑球即Li+位于每4个S2-形成的正四面体中心,晶胞结构如图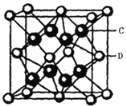 (C为Li+,D为S2-),所以每个晶胞中S2-的数目为
(C为Li+,D为S2-),所以每个晶胞中S2-的数目为![]() =4;Li+位于每4个S2-形成的正四面体中心,所以Li+的配位数为4,而晶体的化学式为Li2S,所以S2-的配位数为8;晶胞体积V=d3pm3,每个晶胞有4个S2-,8个Li+,则晶胞的质量为m=
=4;Li+位于每4个S2-形成的正四面体中心,所以Li+的配位数为4,而晶体的化学式为Li2S,所以S2-的配位数为8;晶胞体积V=d3pm3,每个晶胞有4个S2-,8个Li+,则晶胞的质量为m=![]() ,所以晶胞的密度=
,所以晶胞的密度=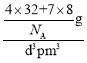 =
=![]() =
=![]() ×1030gcm-3。
×1030gcm-3。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:
【题目】放热反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
CO2(g)+H2(g)在温度t1时达到平衡,c1(CO)=c1(H2O)=1.0 mol·L-1,其平衡常数为K1。其他条件不变,升高反应体系的温度至t2时,反应物的平衡浓度分别为c2(CO)和c2(H2O),平衡常数为K2,则
A.若增大CO的浓度,K2 和K1都增大 B.K2 >K1
C.c2(CO)=c2(H2O) D. c1(CO)>c2(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气体的摩尔质量为Mg/mol,现有该气体mg, 用NA表示阿伏加德罗常数,求下列量:
①该气体的物质的量为______________mol;
②该气体在标准状况下的体积为_________________L;
③该气体在标准状况下的密度为_________________g/L;
④该气体一个分子的质量为_________________g;
⑤该气体m g完全溶解于水(气体与水不反应),得到100mL溶液,所得溶液的物质的量浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取6根铁钉,6支干净的试管及其他材料,如图所示。
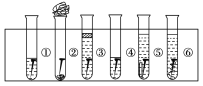
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是____(填试管序号);在电化学腐蚀中,负极反应是____,正极反应是______。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是____________(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称为“国防金属”的镁 ,60%来自海洋,从海水中提取镁的正确方法是( )

A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液―→MgCl2(熔融)
MgCl2溶液―→MgCl2(熔融)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列操作和现象,所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2 (g) | 增大压强,平衡逆向移动 |
B | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热;未出现银镜 | 蔗糖未水解 |
C | 向蛋白质溶液中加入CuSO4溶液和Na2SO4饱和溶液,均产生白色沉淀 | 蛋白质均发生了变性 |
D | 其他条件相同时,Na2S2O3溶液和稀H2SO4反应,升高溶液的温度,析出硫沉淀所需时间缩短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥分析下列氧化还原反应,并按要求填空。2Al+3H2SO4 =Al2(SO4)3+3H2↑_______
(1)氧化剂:________,氧化产物:________;
(2)标准状况下,生成3.36L H2,参加反应的Al的质量是_______,转移的电子的物质的量为_____,若溶液中H2SO4的物质的量浓度为1.5 mol/L,则恰好完全反应需加入的H2SO4溶液的体积_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图所示装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )

编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni元素在生产、生活中有着广泛的应用。 回答下列问题:
(1)基态Ni原子价层电子的排布式为 ____。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体最可靠的科学方法是对固体进行_____。
(3)Ni能与类卤素(SCN)2反应生成Ni(SCN)2。Ni(SCN)2中,第一电离能最大的元素是____;(SCN)2分子中,硫原子的杂化方式是____ ,σ键和π键数目之比为_____。
(4)[Ni(NH3)6](NO3)2中,不存在的化学键为____ (填标号)。
a.离子键 b.金属键 c.配位键 d.氢键
(5)镍合金储氢的研究已取得很大进展。
①图甲是一种镍基合金储氢后的晶胞结构示意图。 该合金储氢后,含1molLa的合金可吸附H2的数目为_____。
②Mg2NiH4是一种贮氢的金属氢化物。在Mg2NiH4晶胞中,Ni原子占据如图乙的顶点和面心,Mg2+ 处于乙图八个小立方体的体心。Mg2+位于Ni原子形成的 ___ (填“八面体空隙”或“四面体空隙”)。 若晶体的密度为dg/cm3,Mg2NiH4的摩尔质量为Mg/mol,则Mg2+和Ni原子的最短距离为 ___ nm(用含d、M、NA 的代数式表示)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com