
����Ŀ�������仯�����ת����������ͼ��ʾ��������ͼΪ��Ӧ�ٹ����������仯������ͼ��
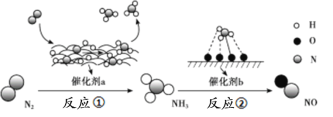

�������������
A.��ͼ��c�����Ǽ������aʱ�������仯����
B.��Ӧ�ٵ��Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g)����H=-92 kJ/mol
2NH3(g)����H=-92 kJ/mol
C.�ڷ�Ӧ���У�����1.25 mol���ӷ���ת�ƣ���μӷ�Ӧ��NH3�����Ϊ5.6 L
D.����a��b�����ѧ��Ӧ�١��ڵĻ�ѧ��Ӧ���ʺ�ƽ��ת����
���𰸡�B
��������
A. ʹ�ô����ܹ����ͷ�Ӧ�Ļ�ܣ��ӿ췴Ӧ���ʣ���������d�Ǽ������aʱ�������仯���ߣ�A����
B. ����ͼʾ��֪��Ӧ���������������߳�600 kJ-508 kJ=92 kJ���ʷ�Ӧ�ٵ��Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g)����H=-92 kJ/mol��B��ȷ��
2NH3(g)����H=-92 kJ/mol��B��ȷ��
C. δָ������������������˲��ܸ��ݵ���ת�Ƶ����ʵ���ȷ������������C����
D. �����ܼӿ컯ѧ��Ӧ�ķ�Ӧ���ʣ�������ʹ��ѧƽ�ⷢ���ƶ�����˲��ܸı����ʵ�ƽ��ת���ʣ�D����
�ʺ���ѡ����B��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������ֻ������Ե����̼�������缫���ϣ�������ZnSO4��Һ���л��߾�������̬����ʣ������ܷ�ӦΪMnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3��xH2O�����ؽṹ��ͼ����ʾ��ͼ�����л��߾���ĽṹƬ�Ρ�
ZnSO4[Zn(OH)2]3��xH2O�����ؽṹ��ͼ����ʾ��ͼ�����л��߾���ĽṹƬ�Ρ�
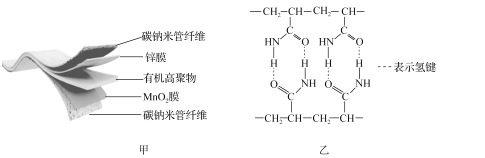
��1��Mn2+�ĺ�������Ų�ʽΪ_____���л��߾�����C���ӻ���ʽΪ_____��
��2����֪CN-��N2��Ϊ�ȵ����壬������±��CN)2������������������Ŀ֮��Ϊ_____��
��3��NO2-�Ŀռ乹��Ϊ_____��
��4��MnO�����Ӿ��壬�侧���ܿ�ͨ����ͼ��Born-Haberѭ������õ���
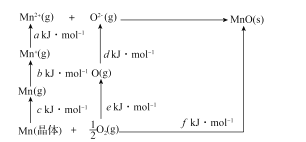
Mn�ĵ�һ��������_____��O2�ļ�����_____��MnO�ľ�������_____��
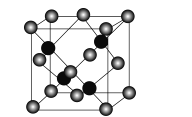
��5��R(�����ṹ��ͼ����Zn��S��ɣ��仯ѧʽΪ_____����Ԫ�ط��ű�ʾ������֪�侧���߳�Ϊacm����þ������ܶ�Ϊ_____g��cm3(�����ӵ�������NA��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2��
��֪���� CO(g)+![]() O2(g) = CO2 (g) ��H=-283kJ��mol-1
O2(g) = CO2 (g) ��H=-283kJ��mol-1
�� H2(g)+![]() O2(g) = H2O (g) ��H=-241.8kJ��mol-1
O2(g) = H2O (g) ��H=-241.8kJ��mol-1
�� H2O (l)=H2O (g) ��H=+44.0kJ��mol-1
(1)H2��ȼ���ȡ�H=________��
(2)д��CO(g)��H2O (g)��������CO2 (g)��H2(g)���Ȼ�ѧ����ʽ��________��
(3)������ʵĻ�ѧ�������������£�
��ѧ�� | O=O(O2) | H��H | H��O |
E/(kJ��mol-1) | x | 436 | 463 |
����x=________kJ��mol-1��
(4)ij��Ӧ2X(g)+Y(g)2Z(g) ��H= -Q kJ��mol-1����Ӧ�����������仯��ͼ��ʾ���������߱�ʾ�������Mʱ�������
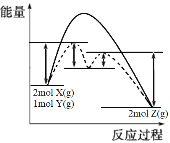
�ټ������M��H________ (�����ı�������������)��
����ʹ�ô�����������Ӧ�У�________ (������һ���������ڶ�����)������Ӧ���ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������۾���ȷ���ǣ� ��
ѡ�� | ʵ����� | ���� | ���� |
A | �� | �ϲ�Һ��ʳȺ�ɫ | �����ԣ� |
B | �� | ��ɫ�������ܽ� |
|
C | ��ʢ�� | ��Һ������ɫ���Թܵ��к�ɫ���� | �����ԣ� |
D | ������ǯ��סһС����ɰֽ��ϸ��ĥ���������ھƾ����ϼ��� | �ۻ��������� | ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ����ϵmA(g)��nB(g) ![]() pC(g)��qD(g)����H��0�����н����д������
pC(g)��qD(g)����H��0�������������
A.���¶Ȳ��䣬�������������С��ԭ����һ�룬��ʱA��Ũ��Ϊԭ����2.1������m��n��p��q
B.��ƽ��ʱ��A��B��ת������ȣ�˵����Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm��n
C.��m��n��p��q���¶Ȳ���ʱѹǿ����ԭ����2�����ﵽ��ƽ��ʱ�������һ����ԭ����![]() ҪС
ҪС
D.��m��n��p��q����������a mol�����ƽ����ϵ���ټ���a mol��B���ﵽ��ƽ��ʱ������������ʵ�������2a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʵ��װ�ã�����ʵ������ȡ�������������ᶡ��������˵���������
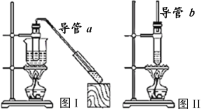
A.����a�͵���b�����ö�����������
B.�����ñ���Na2CO3��Һ��ϴȥ���е���ʹ�
C.������������������ߴ���ת����
D.ͼIװ��������ȡ����������ͼ��װ��������ȡ���ᶡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol/LH2C2O4ˮ��Һ�д���H2C2O4��HC2O4-��C2O42-������̬��̼���ӣ���NaOH��HCl���ڸ���Һ��pH�����ֺ�̼���ӵķֲ�ϵ��������ҺpH�仯�Ĺ�ϵ����ͼ[��֪��a=1.35��b=4.17��Ksp(CaC2O4)=2.3��10-9��������Һ����仯]������˵���������
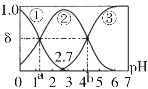
A.pH=5ʱ����Һ����Ҫ��̼����Ũ�ȴ�С��ϵΪ��c(C2O42-)>c(H2C2O4)>c(HC2O4-)
B.��֪pKa=-lgKa����pKa2 (H2C2O4)=4.17
C.0.1mol/LNaHC2O4��Һ�У�c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
D.һ���¶�����CaC2O4������Һ�м�������CaCl2���壬c(C2O42-)����С��c(Ca2+)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2��g����O2��g��![]() 2SO3��g������Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2��g������Ϊ1 mol SO3��g������H����99 kJ/mol��
2SO3��g������Ӧ���̵������仯��ͼ��ʾ����֪1 mol SO2��g������Ϊ1 mol SO3��g������H����99 kJ/mol��
��ش��������⣺

��1��ͼ��A��C�ֱ��ʾ_______��_________��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ������Ӱ�죿________���÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B��______�������ͣ���������___________��
��2��ͼ����H��__________kJ/mol��
��3�������Ӧ����v��SO2��Ϊ0.05 mol/��L��min������v��O2����________mol/��L��min����v��SO3����________mol/��L��min����
��4����֪�������ȼ����Ϊ296 kJ/mol��������S��s������3 mol SO3��g������H_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��100��Cʱ��KW=1.0��10-12���ڸ��¶��£����0.1mol/L Na2A��ҺpH=6��
��H2A��ˮ��Һ�еĵ��뷽��ʽΪ_____��
��������pH=1��������H2A��Һ�ֱ���������Zn��Ӧ��H2A��Һ������H2_____����������������������һ����������
��2����0.4mol/L HA��Һ��0.2mol/L NaOH��Һ�������ϣ���û����Һ��c(Na+)��c(A-)��
�ٻ����Һ��c(A)_____c(HA)����������������������=������ͬ����
�ڻ����Һ��c(HA)+c(A)_____0.2mol/L��
��3����֪�ڳ����²��Ũ�Ⱦ�Ϊ0.1mol/L������5����Һ��pH�������ʾ��
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
������������̼ͨ��NaClO��Һ�е����ӷ���ʽ_____��
��Ũ�Ⱦ�Ϊ0.01mol/L������4�����ʵ���Һ�ֱ��ˮϡ��100����pH�仯��С����_____�����ţ���
a��CH3COOH b��HCN c��HClO d��H2CO3
�۳�����Ũ����ͬ�Ĵ���ʹ����ƻ��ҺpH=6����c(CH3COO-)-c(CH3COOH)=_____mol/L����ȷ��ֵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com