
(9分)pH=12的NaOH溶液100ml,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL。
(2)如果加入pH=10的NaOH溶液,就加 mL。
(3)如果加0.01mol/L的HC1,应加 mL。
【解析】考查pH的计算。
(1)若加水稀释。强碱每稀释10n倍,强碱的pH就减小n个单位,pH由12变为11,则相当于稀释10倍,及最终溶液的体积是1000ml,所以需要水1000ml-100ml=900ml。
(2)若加入强碱。PH=11,则混合后OH-的物质的量浓度为0.001mol/L。所以有 ,解得V=1L.
,解得V=1L.
(3)若加入盐酸,则发生中和反应。因此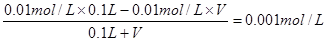 ,解得V=0.0818L。
,解得V=0.0818L。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com