
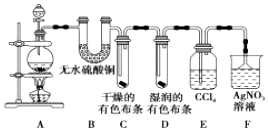
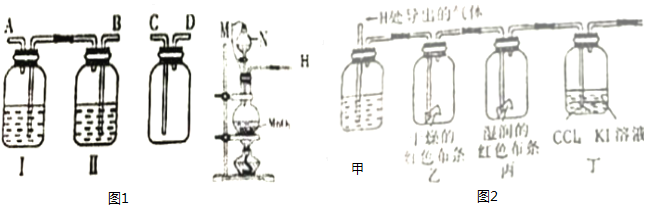
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;二氧化锰与稀盐酸不反应;
(2)①无水硫酸铜与水反应生成蓝色的五水硫酸铜;
②依据干燥氯气不能使有色布条褪色,湿润氯气能够使有色布条褪色验证氯气是否具有漂白性;
③依据氯气与水反应生成盐酸和次氯酸,盐酸能够与硝酸银反应生成白色沉淀,对氯化氢检验造成干扰;
(3)F装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应的离子方程式:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;随着反应进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,稀盐酸与二氧化锰不反应,所以若用0.2mol浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的;
故答案为:MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;随着反应的进行,盐酸不断被消耗,不断生成水,浓盐酸变成稀盐酸,反应停止;
(2)①无水硫酸铜与水反应生成蓝色的五水硫酸铜,用无水硫酸铜检验水蒸气的存在;
故答案为:检验水蒸气;
②干燥的氯气依次通过干燥的有色布条,湿润的有色布条,干燥布条不褪色,湿润布条褪色,说明氯气不具有漂白性,氯气与水反应生成的HClO具有漂白性;
故答案为:氯气无漂白性,氯气与水反应生成的HClO具有漂白性;
③氯气与水反应生成盐酸和次氯酸,盐酸能够与硝酸银反应生成白色沉淀,对氯化氢检验造成干扰,所以应用四氯化碳吸收氯气,防止对F产生干扰;
故答案为:吸收氯气,避免对F产生干扰;
(3)F装置用来检验HCl气体,为了确保实验结论的可靠性,应排除氯气的干扰,在E吸收氯气之后要检验氯气是否完全除去,根据氯气具有强氧化性的性质,可用湿润的淀粉KI试纸检验,如不变色,说明已经完全除去,或湿润的有色布条检验,
故答案为:E;F;AC.
点评 本题考查性质实验方案的设计,题目难度中等,涉及了氯气的制备、氯气的性质、氯离子检验,明确实验的目的与原理是解题的关键,注意掌握氯气的化学性质及检验方法,试题侧重考查了学生的分析、理解能力及化学实验能力.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质:胆矾、一水合氨、硫酸钡、CaO | |
| B. | 酸性氧化物:CO2、SO2、NO2、SiO2 | |
| C. | 混合物:铝热剂、干冰、水玻璃、盐酸 | |
| D. | 弱酸:氢碘酸、醋酸、碳酸、次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 的名称是2,2,4,5-四甲基-3,3-二乙基己烷
的名称是2,2,4,5-四甲基-3,3-二乙基己烷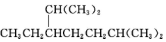 的名称为2,6-二甲基-3-乙基庚烷
的名称为2,6-二甲基-3-乙基庚烷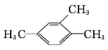 的名称是1,2,4-三甲苯
的名称是1,2,4-三甲苯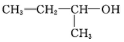 的名称是2-丁醇
的名称是2-丁醇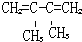 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
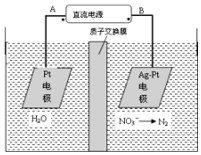 电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.
电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图,请写出阴极的电极反应式2NO3-+12H++10e-=N2↑+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯每个碳原子的未参加杂化的 2p 轨道形成大π键 | |
| B. | CH4中的 4 个 C-H 键都是 H 的 1s 轨道与 C 的 2p 轨道形成的 s-pσ键 | |
| C. | C2H4 中,每个碳原子的 sp2 杂化轨道形成σ键、未杂化的2p 轨道形成π键 | |
| D. | 乙炔分子中,每个碳原子都有两个未杂化的 2p 轨道形成π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
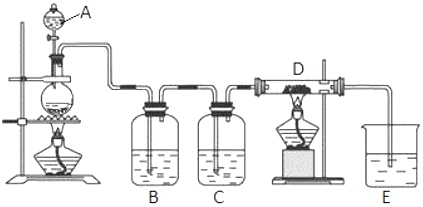
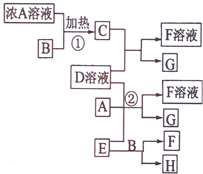 有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.
有关物质存在如图所示的转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质,且受热易升华.实验室中,常用固体E在B的催化下加热制取气体单质H,H能使带火星的木条复燃.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com