
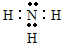 ,故答案为:
,故答案为: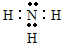 ;
;| 33.6mL×8 |
| 3 |


科目:高中化学 来源: 题型:
 用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 酚酞、NaOH混合溶液 | 溶液红色消失 | SO2具有漂白性 |
| B | NH3 | 酚酞试液 | 溶液变红 | NH3的水溶液显碱性 |
| C | X | 澄清石灰水 | 溶液变浑浊 | X一定是CO2 |
| D | Cl2 | 淀粉、KI混合溶液 | 溶液变蓝色 | Cl2有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.
将1.66g碳酸钠和氢氧化钠的固体混合物完全溶于水,配成稀溶液,然后向该溶液中逐滴加入1mo1?L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
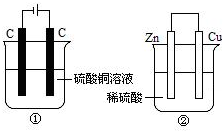 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.已知充电时电池总反应为:LiMn2O4═Li1-xMn2O4+xLi,下列叙述正确的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系.已知充电时电池总反应为:LiMn2O4═Li1-xMn2O4+xLi,下列叙述正确的是( )| A、放电时,正极反应为xLi++xe-═xLi |
| B、放电时,a极锂的化合价不发生变化 |
| C、充电时,b极发生氧化反应 |
| D、充电时,溶液中的Li+从b极向a极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、能通过化合反应制得FeCl2和Fe(OH)3 |
| B、7.8gNa2O2与CO2完全反应,转移0.2mol电子 |
| C、Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性 |
| D、NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时,c(NH3)=5mol?L-1 |
| B、若改变反应起始时固体NH4I的量,保持其他条件不变,平衡时各气体浓度也发生改变 |
| C、反应起始时固体NH4I是5mol |
| D、平衡时HI的分解率是10% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com