
| A、Al 1s22s22p63s23p1 |
| B、S2- 1s22s22p63s23p4 |
| C、Na+ 1s22s22p6 |
| D、F 1s22s22p5 |
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
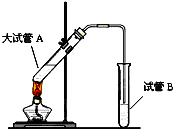 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、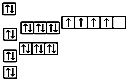 |
B、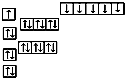 |
C、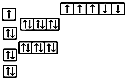 |
D、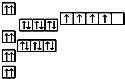 |
查看答案和解析>>
科目:高中化学 来源: 题型:
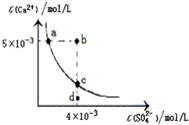
| A、CaSO4在稀硫酸中的溶解性比在纯水中的溶解性 强 |
| B、b点将有沉淀生成,平衡后溶液中c(SO42-)一定等 于3×10-3 mol/L |
| C、d点溶液通过蒸可以变到c点 |
| D、a点对应的Ksp等于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硬质试管中隔绝空气高温加热固体混合物时,有0.6 g碳参加了反应 |
| B、试管中发生的所有氧化还原反应共转移电子0.15 mol |
| C、反应后试管中剩余的固体混合物的总质量为7.2 g |
| D、反应生成铜和氧化亚铜的总物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
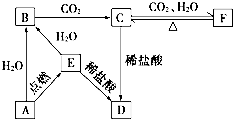 如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.
如图所示,下列各项变化的未知物焰色反应均呈黄色,E为淡黄色粉末.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
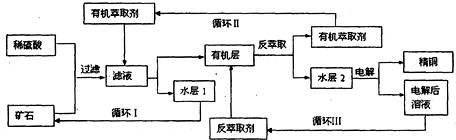
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com