
【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )

M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】垃圾是放错了位置的资源。如废弃的热塑性塑料可通过清洗、熔融,重新制成塑料。塑料属于( )
A.无机非金属材料
B.有机合成材料
C.复合材料
D.合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01molL﹣1r溶液的pH为2,s通常是难溶于水的混合物.上述物质的转化关系如图所示.下列说法正确的是( ) 
A.原子半径的大小W<X<Y
B.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的NaOH溶液滴定相同浓度的一元弱酸HA20mL,滴定过程中溶液的pH随滴定分数(滴定分数= ![]() ) 的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
) 的变化曲线如图所示(忽略中和热效应),下列说法不正确的是
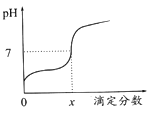
A. HA溶液加水稀释后,溶液中c(HA)/c(A-)的值减少
B. 当滴定分数为1时,溶液中水的电离程度最大
C. 当滴定分数大于1时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)> c(H+)
D. 当滴定分数为x时,HA的电离常数为KHA=(10-7x)/(1-x)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b用导线连接时,Fe片上发生还原反应,溶液中SO42-向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素和化合物说法错误的是
A. 活细胞中,含量最多的元素是H
B. 鸟嘌呤和胞嘧啶数量越多的DNA分子越稳定
C. 氨基酸、多肽链和蛋白质一般都含有氨基和羧基
D. 构成淀粉、纤维素和糖原的单体都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分。
|
|
|
|
|
|
|
| 0 |
第二 周期 | 3 锂 6.941 | 4 铍 9.012 | 5 硼 10.81 |
| 7 氮 14.01 | 8 氧 16.00 | 9 氟 19.00 | 10 氖 20.18 |
第三 周期 | 11 钠 22.99 |
24.31 | 13 铝 26.98 | 14 硅 28.09 |
30.97 | 16 硫 32.06 | 17 氯 35.45 | 18 氩 39.95 |
请结合上图的元素周期表回答下列问题:
(1)金属性最强的是_______,原子半径最小的是_______;(填元素符号)
(2)相对原子质量为30.97的元素属_______(填“金属”或“非金属”),位置![]() 中的元素原子核内的质子数为_______(填数值);
中的元素原子核内的质子数为_______(填数值);
(3)请画出位置![]() 中元素的离子结构示意图____________。
中元素的离子结构示意图____________。
(4)位置![]() 中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,
中的元素形成的一种单质分子的空间结构为正四面体,该分子中的化学键类型为_______,![]() 该分子中所含化学键个数为___________。
该分子中所含化学键个数为___________。
(5)第三周期中有一种非金属元素最高价氧化物对应的水化物难溶于水,但能溶于烧碱溶液,请写出它溶于烧碱溶液的离子反应方程式________________。
(6)由Na、H、S、O四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________。
(7)科学家认为存在NH5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________,写出NH5的电子式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,M为红褐色胶体。
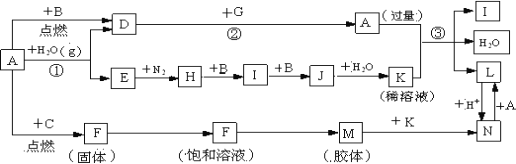
(1)已知A为第26号元素,请写出A元素在周期表中的位置__________。
(2)D与G反应的化学方程式____________________。实验室引发该反应的操作___________。
(3)反应③离子方程式__________________________。
(4)H→I的化学方程式_______________。
(5)现将一试管J气体倒立于水槽中一段时间后,水面上升但不充满;若使水充满整个试管,应向试管中通入一定量__________(填气体的化学式),此时试管中溶液的浓度为________mol/L(气体体积按标准状况计算)(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2molL﹣1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( ) 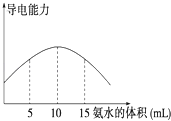
A.0.5%
B.1.5%
C.0.1%
D.1%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com