
【题目】实验表明新型钠离子聚合物电池正负极材料均表现出较快的电极反应动力学,使得电池具备高功率性能。其放电时的工作原理如图,下列说法正确的是

A. 放电时,高聚物发生还原反应
B. 充电时,阳极的电极反应式为 3I- +2e-=I3-
C. 充电时,电极A接电源负极
D. 放电时,当转移0.5 mol电子,NaI溶液中增加0.5NA个Na+
【答案】D
【解析】
图中装置分析反应过程中,电子转移方向可知,高聚物失电子发生氧化反应,为原电池的负极,钠离子移向正极,正极上I3-得到电子发生还原反应生成I-,离子交换膜为阳离子交换膜,据此分析回答。
A.放电时,电子转移方向可知,高聚物在负极失电子发生氧化反应,A错误;
B.充电时,原电池正极为电解池的阳极,阳极的电极反应式为3I--2e-=I3-,B错误;
C.充电时,电极A接电源正极,作阳极,发生氧化反应,C错误;
D.结合放电过程中的电极反应式、电子守恒、电荷守恒计算,放电时,当转移0.5mol电子时,I3-+2e-=3I-,必有0.5mol钠离子通过阳离子交换膜进入正极室,故NaI溶液中增加0.5NA个Na+,D 正确;
故合理选项是D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列各表述正确的是( )
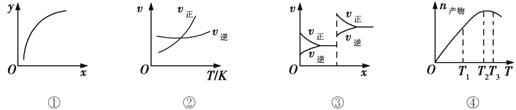
A. 图①表示在恒容容器中MgSO4(s) + CO(g)![]() MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)![]() 2C(g)的反应速率随温度变化的图像,正反应ΔH>0
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)![]() 2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z、R的原子序数依次增大,A、B、C、D、E、F均是由上述元素组成的中学化学常见物质,其中A是四元化合物,C是能使湿润红色石蕊试纸变蓝的气体,D具有漂白性,E是单质。各物质之间存在如图转化关系(部分产物未标出)。下列说法不正确的是( )

A. 简单离子半径大小关系:Y>Z>RB. 简单阴离子的还原性:W>Y>Z
C. 氢化物的沸点:Z>Y>XD. C和E反应生成F是工业制硝酸的重要反应之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等
(1)基态氟原子中,有_______种能量不同的电子。
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是_________________(用离子方程式表示)。(已知AlF63-在溶液中可稳定存在)
(3)BF3与一定量的水形成(H2O)2BF3晶体Q,晶体Q在一定条件下可转化为R:

①晶体R中含有的化学键包括_________(填标号)。
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为_________,阴离子中心原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是___________________________________。
(5)Na3AlF6晶胞结构如图所示:

①位于大立方体体心▽代表________(填离子符号);
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为_______,其中_________%正八面体空隙被Na+填充;
③晶胞边长为x nm,则相距最近的两个Na+之间距离为_____ nm;设Na3AlF6的相对分子质量为M,阿伏加德罗常数为NA,则该晶体密度的计算表达式为________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化工试剂,遇水剧烈水解。实验室可由氮气和钙加热制得氮化钙,实验装置如下图(省略部分固定装置)。

(1)氮化钙中所含的化学键有(填“共价键”或“离子键”)_________。
(2)球形干燥管中的干燥剂可选用(至少写一种)_________,结合化学方程式解释其作用_________。
(3)制备过程中末端导管必须始终插入试管A的水中,目的是①便于观察N2的流速;②_________。
(4)制备氮化钙的操作步骤:①按图示连接好实验装置;②_________;③打开活塞K并通入N2;④点燃酒精灯,进行反应;⑤反应结束后,熄灭酒精灯,继续通N2,使装置冷却至室温;⑥拆除装置,取出产物。
(5)上述步骤中③和④_________(填“能”或“不能”)交换,理由是_________。
(6)氮气不足会影响实验制得Ca3N2的纯度。为测定氮化钙的纯度,实验结束后取一定量的固体混合物于足量水中,微热使气体完全逸出,收集到气体共6.72 L(已折算到标准状况),将该气体通入装有足量灼热CuO的硬质玻璃管中充分反应,测得硬质玻璃管中固体质量减轻6.4 g。则Ca3N2的纯度为_________(用百分数表示,保留一位小数)(注:氨气能被灼热氧化铜氧化,生成一种对环境无污染气体)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液为碱性某蓄电池的反应为Fe+NiO2+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______________(填选项字母)。放电时生成Fe(OH)2的质量为18 g,则外电路中转移的电子数是________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块, 或与该蓄电池的__________(填“正”或“负”)极相连。该电化学防护法称为___________________。
(3)该蓄电池放电时负极电极反应式__________________,充电时阳极电极反应式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com