
| A. | F-的原子结构示意图: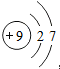 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的分子式:C6H12O6 | D. | 二氧化碳的电子式: |
分析 A.F-核外电子数比质子数多1个;
B.碳碳双键在书写结构简式时,不能省略;
C.葡萄糖分子含有6个C,6个O,12个H;
D.二氧化碳分子中两个C分别于O形成1个C=O而达到8电子稳定结构;
解答 解:A.F-的原子结构示意图: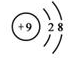 ,故A错误;
,故A错误;
B.乙烯的结构简式:CH2=CH2,故B错误;
C.葡萄糖分子含有6个C,6个O,12个H,分子式:C6H12O6,故C正确;
D.二氧化碳为直线型结构,分子中存在两个碳氧双键,二氧化碳的电子式为: ,故D错误;
,故D错误;
故选:C.
点评 本题考查了常见化学用语的使用,明确原子结构示意图、电子数、结构简式、分子式书写方法和注意事项是解题关键,注意有机物中碳碳双键、三键在书写结构简式时不能省略,题目难度不大,有利于学生养成规范使用化学用语的习惯.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能/kJ.mol-1 | a | b | x | c | d |
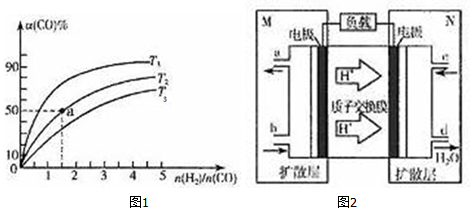
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
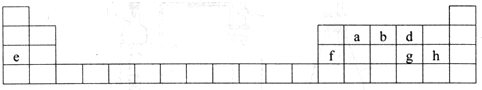
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
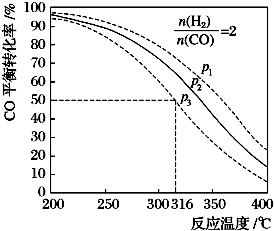
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 400 | 500 | 800 | 1000 |
| K | 2.6 | 1.6 | 1.0 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
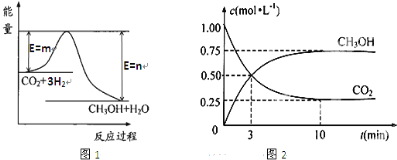
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )
在某容积一定的密闭容器中,可逆反应A(g)+B(g)?xC(g);△H<0,符合如图(I)所示关系,由此推断对图(II)的正确说法是( )| A. | p3<p4,Y轴表示A的转化率 | |
| B. | p3>p4,Y轴表示混合气体的密度 | |
| C. | p3<p4,Y轴表示B的浓度 | |
| D. | p3>p4,Y轴表示混合气体的平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 84% | B. | 24% | C. | 19.6% | D. | 42% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com