
��ѧ�ҿ�����һ�������-����أ��������ܶȼ��ߣ�Ч�ʴﵽ90%���ϣ���������ӵ⻯�(LiI)����ˮ������ԭ����ͼ��ʾ���ܷ�ӦΪ��O2+4LiI+2H2Og 2I2+4LiOH�����ڸõ�ص�����˵������ȷ����
2I2+4LiOH�����ڸõ�ص�����˵������ȷ����
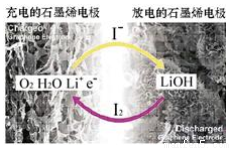
A�����ʱ������ӦΪLiOH+e-=Li+OH-
B�����ʱLi+������������������
C���ŵ�ʱ������ӦΪO2+2H2O+4Li++4e-=4LiOH
D���ŵ�ʱ������I-������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017��������и�����ѧ�ڶ�ʱѵ��14��ѧ�Ծ��������棩 ���ͣ������
������һ�ֿ��Է�����硢�ŵ��װ�á���һ�������ڳ��ͷŵ�ʱ�����ķ�Ӧ�ǣ�NiO2��Fe +2H2O=Fe(OH)2+Ni(OH)2
��1����������Ԫ�����ڱ��е�λ����______________��
��2�������طŵ�ʱ���õ�ط���������Ӧ��������________������ţ���
A. NiO2 B��Fe C. Fe(OH)2 D.Ni(OH)2
��3����������س��ʱ�������ĵ缫��Ӧʽ��____________��
��4���ø����ص�⺬��0.2molNaCl�Ļ����Һ100mL�������·��ת����0.1mo���ӣ��ҵ��صĵ缫��Ϊ���Ե缫�����������������ڱ�״���µ������________�����������Һ��ˮϡ����1L����ʱ��Һ��pH=________________��
��5���õ�ص缫���϶Ի�����Σ�����ڶԵ�ؽ��л��մ��������������������⣺��֪��������Ksp[Fe(OH)3]=1.0��10-34��Ksp[Ni(OH)2]=1.0��10-15��ij��Һ�к���0.1mol/L��Ni2+��0.1mol/LFe3+������μ���NaOH��Һ��������Һ����ı䣩��
���ȳ�����������________��
��Ҫ��ʹFe3+������ȫ��Ni2+����������Һ��pH����Ƶķ�Χ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��ɽ��ʡ��Ӫ�и��������л�ѧ���������棩 ���ͣ�ѡ����
����˵���в���ȷ����( )
A��������pH=7����Һ�У�Fe3+��Mg2+��SO42����Cl���ܴ�������
B���ں���0.1mol��L��1 Fe3+����Һ�У�SCN����Cl����K+���ܴ�������
C���ں���HCO3����SO32����S2����CH3COO�����������ӵ���Һ�м���������Na2O2�����
CH3COO��Ũ�ȱ仯��С
D��NaHSO4��Һ��Ba(OH)2��Һ��Ӧ�����ԣ�2H++SO42-+Ba2++2OH- = BaSO4��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ĸ�����ѧ��ͳ������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���20ml0.10mol/LNaHCO3��Һ�еμ�0.10mol/LCaCl2��Һ��pH=7���а�ɫ�������ɣ�������ų����Է�Ӧ���û��Һ������˵������ȷ����( )
A��c(Na+)=c(Cl-)>c(HCO3-)>c(CO32-)=c(Ca2+)
B�����ڵ���ƽ�⡢ˮ��ƽ��ͳ����ܽ�ƽ��
C��c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)
D����Ӧ�����ӷ���ʽ��2HCO3-+Ca2+=CaCO3��+H2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ĸ�����ѧ��ͳ������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£����������ͬ��pH��Ϊ2������ʹ�����Һ������˵������ȷ����
A�������е�c(Cl-)������Һ�е�c(CH3COO-)���
B���ֱ�������CaCO3��Ӧ���ų���CO2������
C���ֱ���ˮϡ����ͬ������n(Cl-)<c(CH3COO-)
D���ֱ�����Һ������80�棬������Һ��pH��С�������pH����(�����ǻӷ�)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ�����л�ѧ���������棩 ���ͣ�ʵ����
ij��ѧ��ȤС����ʵ������ȡƯ�ۣ���̽��������ʯ���鷴Ӧ�������Ͳ����֪���ٶ���������Ũ���ᷴӦ���Ʊ�������ͬʱ����MnCl2�� �������ͼ�ķ�ӦΪ���ȷ�Ӧ���¶Ƚϸ�ʱ�������ͼ�ܷ������·�Ӧ��3Cl2+6NaOH 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
����ȤС�����������ʵ��װ�ã�����ʵ�顣
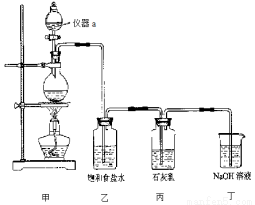
��ش��������⣺
��1��������a������____________��
�ڱ���ʳ��ˮ��������_____ _______��
_______��
�۸���ȤС����100mL 12mol/L������8.7g MnO2�Ʊ��������������������������ʯ���鷴Ӧ���������������Ƶ�Ca(ClO)2______________g����д������̣�
��2��С���Ա��Ca(OH)20.25 mol��ʯ�������Խϴ������ͨ��������������Ӧ���ò�����Cl�������ʵ���Ϊ0.37mol���������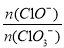 =______________��
=______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ�����л�ѧ���������棩 ���ͣ�ѡ����
ʵ������һ ����ɫ���壬���ܺ���Na2CO3��NaHCO3��NaCl�е�һ�ֻ���֡����и���ʵ����ʵ�ó��Ľ�����ȷ����
����ɫ���壬���ܺ���Na2CO3��NaHCO3��NaCl�е�һ�ֻ���֡����и���ʵ����ʵ�ó��Ľ�����ȷ����
A��ȡһ�������壬�ܽ⣬����Һ��ͨ��������CO2���۲쵽�о���������˵��ԭ������һ������Na2CO3
B��ȡһ�������壬�ܽ⣬����Һ�м�������CaO��ĩ����ַ�Ӧ��۲쵽�а�ɫ�������ɣ�˵��ԭ������һ������Na2CO3
C��ȡһ�������壬�ܽ⣬����Һ�еμ�����AgNO3��Һ���۲쵽�а�ɫ�������ɣ�˵��ԭ������һ������NaCl
D����ȡ3.80g���壬���������أ�����������0.620g��������ϡ�����ܽ�������壬��ַ�Ӧ���ռ���0.880g���壬˵��ԭ�����н�����Na2CO3��NaHCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�꽭��ʡ��һ�����л�ѧ���������棩 ���ͣ�ѡ����
���������У���ֻ�������ԣ�ֻ�л�ԭ�ԣ��������������л�ԭ�Ե�˳�����е�һ����
A��F2��K��HCl B��Cl2��Al��H2 C��NO2��Na��Br2 D��O2��SO2��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ������������ѧ�߶�ʵ��������л�ѧ���������棩 ���ͣ�ѡ����
��TiO2 ת��Ϊ TiCl4 �ǹ�ҵұ�������ѵ���Ҫ��Ӧ֮һ����֪��
TiO2(s)��2Cl2(g)=TiCl4(l)��O2(g) ��H����140.5 kJ��mol��1
C(s��ʯī)��1/2O2(g)=CO(g) ��H����110.5 kJ��mol��1
��Ӧ TiO2(s)��2Cl2(g)��2C(s��ʯī)=TiCl4(l)��2CO(g)�Ħ�H ��
A����80.5 kJ��mol��1 B����30.0 kJ��mol��1 C����30.0 kJ��mol��1 D����80.5 kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com