
下列关于乙醇性质的说法正确的是
A. 乙醇是无色无味的液体 B. 乙醇能使紫色石蕊试液变红
C. 乙醇不能与金属钠反应 D. 乙醇能被酸性高锰酸钾溶液氧化
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源:2016-2017学年湖南省衡阳市高二理科实验班下学期第一次月考理综化学试卷(解析版) 题型:实验题
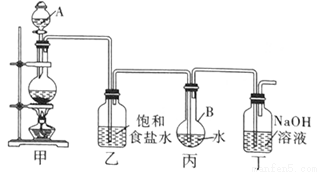
(1)写出装置甲中发生反应的化学方程式: 。
装置甲中的仪器使用前需要检漏的有 (写名称)。
(2)利用装置丙制取饱和氯水并测其pH值。
①证明氯水已饱和的现象是 。
②测定饱和氯水的pH方法是 。
③若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是 。
(3)饱和氯水与石灰石的反应是制取较浓的HClO溶液的方法之一。某同学运用这一方法,尝试制取HClO溶液并进行了如下定性实验:
i.在试管中加入过量的块状碳酸钙,再加入约20ml饱和氯水,充分反应,有少量气泡产生,溶液的黄绿色褪去;
ii.过滤,将滤液滴在有色布条上,发现其漂白性更强;
iii.为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立刻产生大量气泡;
第三份加热,看到溶液变浑浊且有大量无色气体产生。
经检测,上述实验中产生的无色气体均为CO2气体。
② 试解释可以在饱和氯水中加入石灰石制备HClO的原因: 。(用有关的方程式结合文字回答)
②试根据所学知识推测,在ii的滤液中含有的溶质,除了溶解的极少量氯气外,还含有的其他溶质为 (写化学式)。
③写出步骤iii中第一份滤液发生反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:选择题
一定条件下,0.3molX(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g)  2Z(g), ΔH=-aKJ/mol,下列说法正确的是
2Z(g), ΔH=-aKJ/mol,下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,且反应放出0.1aKJ的热量
C. 达到平衡后,若向平衡体系中充入西游气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
反应2NaClO3+Na2SO3+H2SO4===2ClO2↑+2Na2SO4+H2O可制备高效消毒剂ClO2。对于该反应的说法正确的是
A. NaClO3被氧化 B. Na2SO3是还原剂
C. H2SO4是氧化剂 D. 每生成1 mol ClO2转移2 mol电子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
操作规范是化学实验的基本要求。下列实验操作正确的是
A. 检查容量瓶是否漏水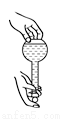 B. 给液体加热
B. 给液体加热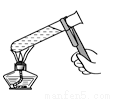
C. 滴加试液 D. 过滤
D. 过滤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:选择题
水能参与很多化学反应。下列物质不能与水反应的是
A. Na B. Cl2 C. CaO D. SiO2
查看答案和解析>>
科目:高中化学 来源:2017届山东省青岛市高三第一次统一质量检测理综化学试卷(解析版) 题型:简答题
氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
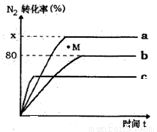
①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s) Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+ [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省“江南十校”高三3月联考理综化学试卷(解析版) 题型:选择题
高铁电池是一种可充电电池,其设计图如下所示:负极材料是Zn,氧化产物是Zn(OH)2,正极材料是K2FeO4(易溶盐),还原产物是Fe(OH)3,电解质溶液是KOH水溶液。下列有关说法正确的是
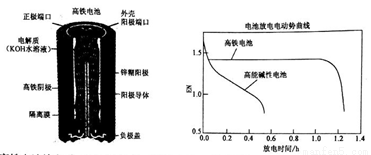
A. 高铁电池放电时正极反应为:Zn+2OH--2e-=Zn(OH)2
B. 高铁电池充电时阴极反应为Fe(OH)3+5OH--3e-=FeO42-+4H2O
C. 高铁电池放电时的总反应为:2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. 高能碱性电池比高铁电池工作电压更稳定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省哈尔滨市高二3月月考化学试卷(解析版) 题型:选择题
用如图所示的装置进行实验,反应一段时间后断开K,向右侧烧杯中加入0.1molCuO后CuSO4溶液恰好恢复到反应前的浓度和pH。下列说法中不正确的是
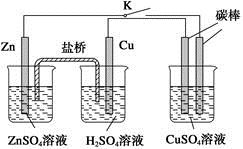
A. 铜棒为正极,其电极反应式为2H++2e-==H2↑
B. 烧杯右侧碳棒为阴极,其电极表面有红色物质析出
C. 反应中消耗锌的质量为13g
D. 导线中通过的电子的物质的量为0.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com