
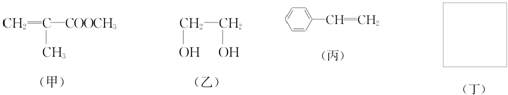
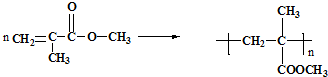
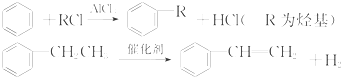
 利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$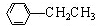 +HCl.
+HCl. 分析 (1)根据有机物甲的结构简式确定不含氧原子的官能团,有机物甲含有C=C双键,可以与溴发生加成反应,可以被酸性高锰酸钾氧化;
(2)淀粉水解生成葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇;
(3)甲发生聚合反应得丁,根据甲的结构和加聚反应的特征可写化学方程式;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下生成苯乙烯.
解答 解:(1)根据有机物甲的结构简式可知不含氧原子的官能团为碳碳双键,有机物甲含有C=C双键,可以与溴发生加成反应,Br2的CCl4溶液褪色,可以被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,不能使石蕊溶液褪色,
故答案为:碳碳双键;ac;
(2)淀粉水解生成葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴的四氯化碳溶液发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇,第三步B→C反应为消去反应,
故答案为:C6H12O6;消去反应;
(3)甲发生聚合反应得丁,反应方程式为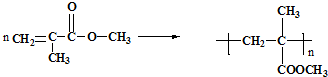 ,
,
故答案为: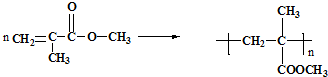 ;
;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下发生消去反应生成苯乙烯,属于取代反应的化学方程式为 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$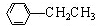 +HCl,故答案为:
+HCl,故答案为: +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$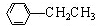 +HCl.
+HCl.
点评 本题考查有机物的推断与合成,涉及有机反应类型、反应方程式书写、官能团的性质等,是对所学知识的综合考查,较好的考查学生的思维能力,题目难度中等.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
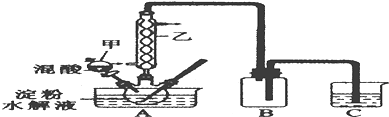
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 排布在K、L、M三个电子层上 | B. | 3p能级上有2个空轨道 | ||
| C. | 共有16种不同的运动状态 | D. | 共有5种不同的能级 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 |
| c(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1•min-1 | B. | 0.6mol•L-1•min-1 | ||
| C. | 0.3mol•L-1•min-1 | D. | 0.2mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com