
分析 根据甲烷和乙烯的体积比计算出1L混合气体中含有甲烷、乙烯的体积,然后根据n=$\frac{V}{{V}_{m}}$计算出甲烷的物质的量,据此进行解答.
解答 解:CH4和C2H4混合气体的体积比为3:1,在1L混合气体中含CH4的体积为:V(CH4)=1L×$\frac{3}{1+3}$=0.75L、V(C2H4)=1L-0.75L=0.25L;
标准状况下0.75L CH4的物质的量为:n(CH4)=$\frac{0.75L}{22.4L/mol}$≈0.0335mol,该混合气体中含有CH4的质量为:m(CH4)=16g/mol×0.0335mol=0.54g,
故答案为:0.54;0.25.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系为解答关键,试题培养了学生的分析能力及化学计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4与铝粉 | B. | Al2O3与铁粉 | C. | CuO与炭粉 | D. | Fe2O3与炭粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 4 | 1 | 42 | 10 |
| 反应后质量/g | 待测 | 20 | 6 | 31 |
| A. | 该变化的基本反应类型是分解反应 | |
| B. | 参加反应的甲、丙的质量比为1:9 | |
| C. | 乙、丁的相对分子质量比一定为10:9 | |
| D. | 甲反应后的质量为8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19g H3O+共用的电子对数为2NA | |
| B. | 常温下,1L0.1mol/L AlCl3溶液中阳离子数小于0.1NA | |
| C. | 标准状况下,1.4gN2和CO的混合气体中含有的电子数为0.7NA | |
| D. | 200mL2.5mol/L乙醇溶液中含有的分子总数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
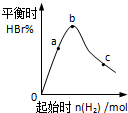 1200℃时可用反应 2BBr3(g)+3H2(g)$?_{催化剂}^{高温}$2B(s)+6HBr(g) 来制取晶体硼.
1200℃时可用反应 2BBr3(g)+3H2(g)$?_{催化剂}^{高温}$2B(s)+6HBr(g) 来制取晶体硼.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com