
在一定条件下,相同pH的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是10-amol/L和10-bmol/L,在此温度下,下列说法正确的是
A.a<b B.Kw=1.0×10-(7+ a) C.a=b D.Kw=1.0×10-(b+ a)
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
下列化工生产过程中,未涉及氧化还原反应的是
A.海带提碘 B.氯碱工业 C.候氏制碱法制碱 D.海水提溴
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法不正确的是


A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子
C.仅由核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
按碳骨架分类,下列说法正确的是
A.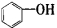 属于醇类化合物 B.
属于醇类化合物 B. 属于芳香族化合物
属于芳香族化合物
C. 属于脂环化合物 D.CH3CH(CH3)2属于链状化合物
属于脂环化合物 D.CH3CH(CH3)2属于链状化合物
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高二上期中化学试卷(解析版) 题型:填空题
(1)某温度下重水(D2O)的离子积常数为1.6×10-15,像定义pH一样来规定pD=-lgc(D+),请回答以下问题:
①写出重水的电离方程式 。
②该温度下,重水中的pD=_____ ___(已知lg2=0.3)。
③0.01 mol/L的NaOD溶液中pD=____ ____。
(2)双氧水(H2O2)和水都是极弱电解质,但H2O2比水更显酸性。
①若把H2O2看成是二元弱酸,请写出它在水中第一步电离的方程式:______________。
②鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可以形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:_____________________。
③水电离生成H3O+ 和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离方程式为:_______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高二上期中化学试卷(解析版) 题型:选择题
水的电离平衡曲线如下图所示,下列说法不正确的是

A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用:温度不变在水中加入少量的酸
C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年青海师大附中高二上期中化学试卷(解析版) 题型:选择题
某温度下,向2L恒容密闭容器中充入1.0molA和1.0molB,发生反应A(g)+B(g) C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
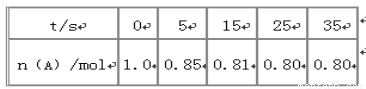
A.反应在前5s的平均速率v(A)= 0. 17mol/(L·s)
B.保持其他条件不变,升高温度,平衡时c(A)=0.41mol/L,则反应的△H>0
C.相同温度下,起始时向容器中充入2.0molC,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 molA、0.20 molB和1.0 molC,反应达到平衡前v(正)<v(逆)
molC,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上期中化学卷(解析版) 题型:选择题
某种橡胶分解产物为碳氢化合物,对这种碳氢化合物作如下实验:
① 若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过石灰水,石灰水增重2.2 g。
② 经测定,该碳氢化合物( 气体)的密度是相同条件下氢气密度的34倍。
气体)的密度是相同条件下氢气密度的34倍。
③ 该碳氢化合物0.1 mol能和32 g溴起加成反应.
④ 经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。下列说法正确的是( )
A.该碳氢化合物为2-甲基-1,3-戊二烯
B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物
C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物
D.该碳氢化合物与足量氢气加成时可以生成正戊烷
查看答案和解析>>
科目:高中化学 来源:2016-2017学年内蒙古高二上月考二化学卷(解析版) 题型:选择题
分析如图所示的四个原电池装置,其中结论正确的是

A.①②中Mg作为负极,③④中Fe作为负极
B.②中Mg作为正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作 为负极,电极反应式为Fe-2e-===Fe2+
为负极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作为正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com