
| A. | 醛基的结构简式-COH | B. | 2-乙基-1,3-丁二烯分子的键线式: | ||
| C. | 丙烷分子的比例模型: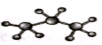 | D. | 四氯化碳分子的电子式: |
分析 A.醛基中存在碳氧双键;
B.首先写出结构式,根据结构式再写出键线式;碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略;
C.比例模型能够体现出原子体积的相对大小,题中为丙烷的球棍模型;
D.氯原子未成键的孤对电子对未画出;
解答 解:A.醛基为醛类的官能团,醛基的结构简式为:-CHO,故A错误;
B.2-乙基-1,3-丁二烯,1,2和3,4号C上含有碳碳双键,在2号C含有1个乙基,该有机物的结构简式为:CH2=C(CH2CH3)-CH=CH2,所以其键线式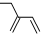 ,故B正确;
,故B正确;
C.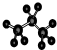 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故C错误;
,故C错误;
D.氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故D错误;
,故D错误;
故选B.
点评 本题主要考查了常见的化学用语,明确电子式、球棍模型、比例模型、键线式即可解答,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④⑥ | C. | ①③④⑤⑥ | D. | ⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | (CH3)2CHOH | ||
| C. | CH3CH2C(CH3)2CH2OH | D. | CH3CH2C(CH3)2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500mL溶液中所含K+、SO42-总数为0.1NA | |
| B. | 500mL溶液中含有0.1NA个K+离子 | |
| C. | 1L溶液中K+离子浓度是0.2mol/L | |
| D. | 2L溶液中SO42-离子浓度是0.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
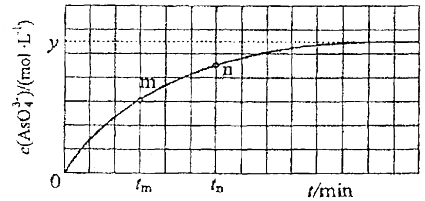
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氰分子中四原子共直线,是非极性分子 | |
| B. | 氰分子中C≡N键长大于C≡C键长 | |
| C. | 氰气分子中含有σ键和π键 | |
| D. | 氰化氢在一定条件下能与烯烃发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com